
分析 ①铁和稀硫酸反应生成硫酸亚铁和氢气;
②硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠;
离子方程式中单质、气体、沉淀、弱电解质要写化学式.
解答 解:①铁和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe 2++H2↑,故答案为:Fe+2H+=Fe 2++H2↑;
②硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,离子方程式为Cu 2++2OH-=Cu(OH)2↓,故答案为:Cu 2++2OH-=Cu(OH)2↓.
点评 本题考查离子方程式书写,为高频考点,明确离子方程式书写规则是解本题关键,注意不能漏写或添加,要遵循原子守恒、电荷守恒和转移电子守恒,有些化学反应还与反应物浓度、反应物的量及反应条件有关,题目难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 杂质 | 加入试剂 | 离子方程式 |
| Na2SO4 | ||
| MgCl2 | ||
| CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂没有固定的熔点和沸点,油脂是混合物 | |
| B. | 天然油脂大多是由混甘油酯分子构成的混合物 | |
| C. | 油脂的主要成分是高级脂肪酸的甘油酯,是酯的一种 | |
| D. | 油脂不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:
在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
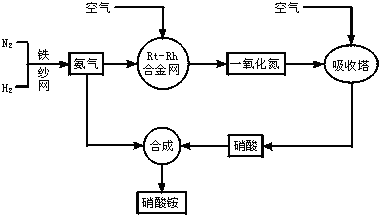
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com