
| A. | 氯化钠 | B. | 硫酸钙 | C. | 硫酸镁 | D. | 氯化镁 |
分析 海水在浓缩过程中析出盐的种类和质量(单位g/L)
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
解答 解:溶液在蒸发过程中,溶解度越小,越容易析出,当海水密度达到1.13g/mL时,由于硫酸钙的溶解度最小,则首先析出的盐是CaSO4,
故选B.
点评 本题考查海水资源的应用,为高频考点,把握海水密度与物质的溶解度为解答的关键,侧重分析与应用能力的考查,注意溶解度小的先析出,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
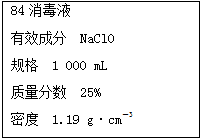 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
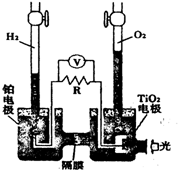 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将电能转化为化学能 | |
| B. | 铂电极上发生的反应为:2H++2e-=H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中 c(H2CO3)>c(CO32-) | |
| B. | 常温下,该溶液的pH>7 | |
| C. | 该溶液中阳离子总数小于阴离子总数 | |
| D. | 常温下,加水稀释时$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 实验室制氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| C. | 稀硫酸中加氢氧化钡到溶液呈中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| D. | 氢氧化钠溶液中吸收少量二氧化硫:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com