
| A、15% | B、10.5% |
| C、9% | D、5% |
| ||
| ||
| 2体积 |
| 20% |
| 1体积 |
| 1体积+10体积 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、锌片和铜片均有气泡产生 |
| B、溶液的pH增大,Zn2+浓度增大 |
| C、溶液中的SO42-向正极移动 |
| D、电子从锌片流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(H+) |
| B、Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
| C、加入少量NaOH固体,水解平衡左移,溶液pH增大 |
| D、稀释该溶液,溶液中c(H+)和c(OH-)都减少,KW减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②④⑤ |
| C、②④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:C(Na+)>C(SO42-)>C(NH4+)>C(OH-)=C(H+) |
| B、0.1mol?L-1pH为4的NaHB溶液中:C(HB-)>C(H2B)>C(B2-) |
| C、10mL 0.5mol?L-1 CH3COONa溶液与6mL 1mol?L-1盐酸混合:C(Cl-)>C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D、pH相等且处于相同温度下的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液C[(NH4)2SO4]<C[(NH4)2Fe(SO4)2]<C(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥⑧⑩ |
| B、①④⑤⑥⑧⑨ |
| C、①②④⑥⑧⑨ |
| D、②③④⑤⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?CO32-+H3O+ |
| B、HCO3-+H2O?H2CO3+OH- |
| C、HCO3-+OH-?CO32-+H2O |
| D、CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
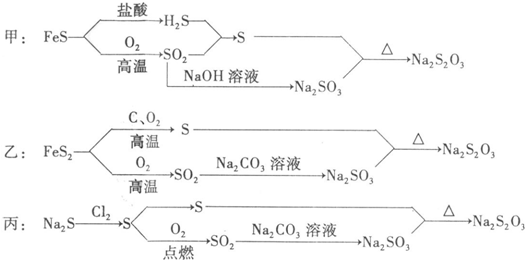
查看答案和解析>>
科目:高中化学 来源: 题型:
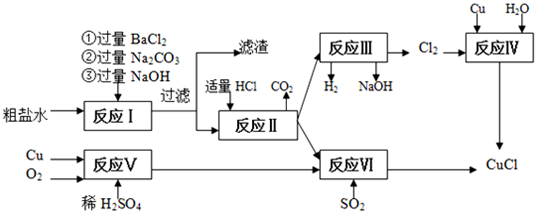
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com