
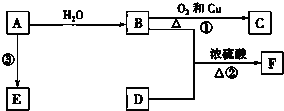
 ��֪A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ�����չˮƽ��B��D����ʳ�����ֳ������л��F��һ������ζ�����ʣ�F��̼ԭ������D������������AΪ��Ҫԭ�Ϻϳ�F�߷��ӻ�����E����ϳ�·����ͼ��ʾ��
��֪A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ�����չˮƽ��B��D����ʳ�����ֳ������л��F��һ������ζ�����ʣ�F��̼ԭ������D������������AΪ��Ҫԭ�Ϻϳ�F�߷��ӻ�����E����ϳ�·����ͼ��ʾ��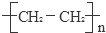 ����Ӧ���ͣ��Ӿ۷�Ӧ��
����Ӧ���ͣ��Ӿ۷�Ӧ������ A�IJ���ͨ����������һ������ʯ�ͻ���ˮƽ����A��CH2=CH2����ϩ��ˮ�����ӳɷ�Ӧ����BΪCH3CH2OH���Ҵ�����������Ӧ����CΪCH3CHO��B��D����ʳ�����ֳ������л��F��һ������ζ�����ʣ�F��̼ԭ������D������������֪DΪCH3COOH���������Ҵ�����������Ӧ����FΪCH3COOCH2CH3����ϩ�����Ӿ۷�Ӧ���ɸ߷��ӻ�����EΪ ���ݴ˽��
���ݴ˽��
��� �⣺A�IJ���ͨ����������һ������ʯ�ͻ���ˮƽ����A��CH2=CH2����ϩ��ˮ�����ӳɷ�Ӧ����BΪCH3CH2OH���Ҵ�����������Ӧ����CΪCH3CHO��B��D����ʳ�����ֳ������л��F��һ������ζ�����ʣ�F��̼ԭ������D������������֪DΪCH3COOH���������Ҵ�����������Ӧ����FΪCH3COOCH2CH3����ϩ�����Ӿ۷�Ӧ���ɸ߷��ӻ�����EΪ ��
��
��1��A�Ľṹ��ʽΪCH2=CH2��BΪCH3CH2OH������B���ʵ���Ҫ�����ŵ�����Ϊ�ǻ���
�ʴ�Ϊ��CH2=CH2���ǻ���
��2����Ӧ�ٵĻ�ѧ����ʽΪ��2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O������������Ӧ��
��Ӧ�۵Ļ�ѧ����ʽΪ��nCH2=CH2$\stackrel{����}{��}$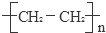 �����ڼӾ۷�Ӧ��
�����ڼӾ۷�Ӧ��
�ʴ�Ϊ��2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O��������Ӧ��nCH2=CH2$\stackrel{����}{��}$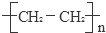 ���Ӿ۷�Ӧ��
���Ӿ۷�Ӧ��
��3������NaOH��Ӧ��F��ͬ���칹�����������ᣬ���б�������������������������������ж��ᡢ2-�����ᣬ����5�֣�
�ʴ�Ϊ��5��
���� ���⿼�������ƶϡ������š��л���Ӧ����ʽ��д������2����ͬ���칹����д�ȣ��漰ϩ��������ȩ�������������ת�������ضԻ���֪ʶ�Ĺ��̣�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu��NO3��2 | B�� | NO | C�� | H2O | D�� | H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | 2 mol H2��g����1 mol O2��g���������������2 mol H2O��g�� ������������� | |
| B�� | ������ȼ����Ϊ��H=-241.8 kJ•mol-1 | |
| C�� | H2O��g������H2O��l��ʱ���ϼ����յ�����С�ڳɼ��ų������� | |
| D�� | Һ̬ˮ�ֽ���Ȼ�ѧ����ʽΪ��2H2O��l���T2H2��g��+O2��g����H=+571.6 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
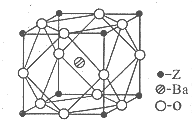 A��B��C��D��ZΪ���ڱ�ǰ������Ԫ�أ�ԭ���������ε�������֪��
A��B��C��D��ZΪ���ڱ�ǰ������Ԫ�أ�ԭ���������ε�������֪���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ϳɸ�Ч���ȶ������۵�̫���ܹ��ת�����ϣ��ǿ�������̫���ܵĹؼ� | |
| B�� | �����������ոѻ�����������������͡������ķ�ɢ������ͬ | |
| C�� | ������ȥ�۵�ԭ����������ˮ��Һ���ܵ���������ӣ���ˮ���ţ���Ӳ֬������ӣ����ͻ��ţ��������ǵĹ�ͬ�����£�ͨ����ϴ�����·��ϵ����ۡ�����ˮ�� | |
| D�� | �ҹ���������3D��ӡ���������ѺϽ��ĩΪԭ�ϣ�ͨ�������ۻ����ѻ���������ɻ��ѺϽ�ṹ��������ʱ���ý����ƻ�ԭ��Ӧ���Ȼ�������ȡ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
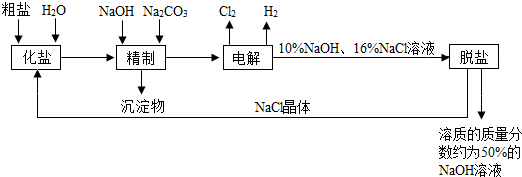
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ش��� | �������� |
| A | ����Ϊ��ͬ�������ܶ���С������ |
| B | ��̬ԭ�����������Ų�ʽΪnsnnpn |
| C | ��Ԫ��E����ͬһ�����ҵ縺�Խ�����E |
| D | λ�ڵ��������ҵ�һ��������С |
| E | ˫ԭ�ӷ��ӵ����ڱ�״�����ܶ�Ϊ1.4285g/L |
| F | �����г��õĽ������ڿ����б���ͨ���γ�һ�����ܵ�����Ĥ |
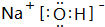 ��F��������ȿ��Ժ�ǿ�ᷴӦҲ���Ժ�ǿ�Ӧ����д������������NaOH��Һ��Ӧ�����ӷ���ʽAl2O3+2OH-=2AlO2-+H2O��
��F��������ȿ��Ժ�ǿ�ᷴӦҲ���Ժ�ǿ�Ӧ����д������������NaOH��Һ��Ӧ�����ӷ���ʽAl2O3+2OH-=2AlO2-+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͭ��������������Ը�ǿ | |
| B�� | ����ͭ�ڷ�Ӧ�п����������� | |
| C�� | ����TiO2�ڲ�ͬ�ܼ��о��γ��˽��� | |
| D�� | ����TiO2�к�ǿ���Ȼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | HA��Ũ�ȣ�mol/L�� | NaOH��Ũ�ȣ�mol/L�� | �����Һ��PH |
| �� | 0.2 | 0.2 | PH=a |
| �� | C1 | 0.2 | PH=7 |
| �� | 0.1 | 0.1 | PH=10 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com