
[化学──选修2 :化学与技术](15分)工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下。
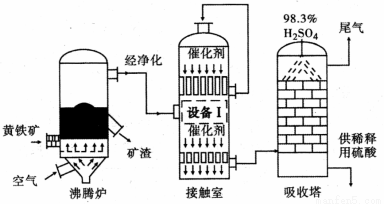
(1)黄铁矿在沸腾炉中反应的化学方程式为 。
(2)为充分利用反应放出的热量,接触室中应安装 (填“设备Ⅰ ”的名称)。
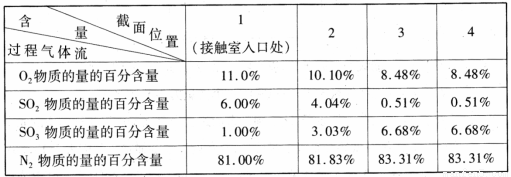
(3)原料气在一定条件下通入接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为 (精确到 0. l )。
(4)在吸收塔中将SO3转化成硫酸,使用98.3 %的硫酸从上方喷淋,而不使用水的理由是 。吸收塔中填充有许多瓷管,其作用是 。
(5)尾气中常含有N2、O2 、SO2、微量的SO3等。为了综合利用尾气,可将其通人氨水中,再按一定比例加人碳酸氢铵,降低温度析出含结晶水的晶体。已知该结晶水合物的相对分子质量为134 , 则其化学式为 。
(6)能用于测定硫酸尾气中SO2含量的是 (填标号)。
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:简答题
(14分)综合利用CO2、CO对构建低碳社会有重要意义。
(1)Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为____________。
(2)固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。
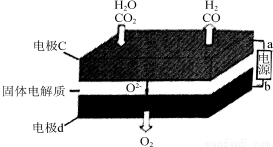
①b为电源的________(填“正极”或“负极”)。
②写出电极c发生的电极反应式:________、________________。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4)已知: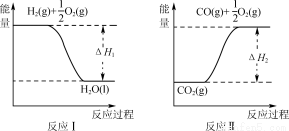
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) CH3OH(l)的ΔH,则ΔH=_____。
CH3OH(l)的ΔH,则ΔH=_____。
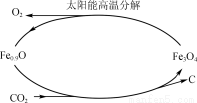
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17 %。下列说法不正确的是
A.CO2属于酸性氧化物
B.CO2是导致酸雨发生的主要原因
C.可用Na2CO3溶液捕捉(吸收)CO2
D.使用氢能源替代化石燃料可减少CO2排放
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:填空题
(14分)煤可以通过气化和液化转变为清洁能源并提高燃烧效率。
煤气化的主要反应是:C(g)+ H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g) H
CH3OH(g) H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(H)分别为a、b、c,则上述反应的H= 。
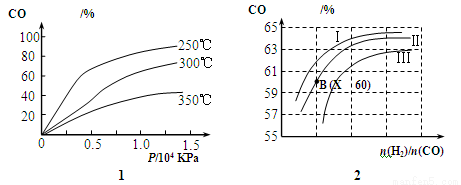
(2)图1表示CO的转化率与温度、压强之间的关系,图2表示CO的转化率与起始投料比n(H2)/n(CO)、温度的变化关系,曲线I、Ⅱ、Ⅲ对应的温度分别为T1、T2、T3,则T1、T2、T3的大小关系为 ,理由 。测得B(X,60)点氢气的转化率为40%,则X= 。
(3)一定条件下,将2 mol CO和4 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2 mol,则此时CH3OH(g)的物质的量浓度为 ,平衡常数K= 。下列说法中能说明反应已达到平衡状态的是 (填选项前的字母)。
A.混合气体的平均摩尔质量不变
B.一氧化碳的消耗速率等于甲醇的生成速率
C.CO和H2的物质的量之比保持不变
D.混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g)  CO2(g)+H2(g) H=—41 kJ/mol
CO2(g)+H2(g) H=—41 kJ/mol
相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.容器①中CO反应速率等于H2O的反应速率
D.平衡时,两容器中CO2的浓度相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl—、NO3— | 不能大量共存,Al3++3OH—=Al(OH)3↓ |
B | 由水电离出的c(H+) =1×10—13mol/L | K+、NH4+、Cl—、AlO2— | 能大量共存 |
C | pH=1的溶液 | Fe3+、NH4+、I—、SO42— | 不能大量共存, 2Fe3++2I—=2Fe2++I2 |
D | 通入少量SO2气体 | K+、Na+、ClO—、SO42— | 不能大量共存,2ClO—+ SO2+H2O=2HClO+ SO32— |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:简答题
【化学—选修3:物质结构与性质】(15分)中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物。回答下列问题:
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)叠氮酸(HN3)是一种弱酸,可电离出H+和N3一。
①N3一的立体构型是 形:与N3一互为等电子体的一种分子是 (填分子式)。
②叠氮化物能与Co 3十形成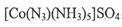 ,该配合物中心离子的配位数为 ;
,该配合物中心离子的配位数为 ;
基态钻原子的价层电子排布式为
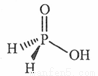
(3)磷能形成多种含氧酸,某资料认为次磷酸的结构如图。按此结构,P原子采用的杂化方式为 ,次磷酸分子中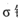 键与
键与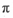 键数目之比为 ,次磷酸属于 酸(填“强”或“弱,’),lmol次磷酸最多能与 mo1NaOH发生中和反应。
键数目之比为 ,次磷酸属于 酸(填“强”或“弱,’),lmol次磷酸最多能与 mo1NaOH发生中和反应。
(4)己知钾的一种化合物KIC12受热可分解,倾向于生成晶格能更大的物质。则下列化学反应更易发生的是

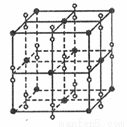
(5)钾在氧气中燃烧时得到多种氧化物,其中一种是面心立方结构,晶胞结构如下图所示。若该氧化物的密度是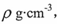 ,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1L 0.1mol/L该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式: Fe3++SO42-+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com