
【题目】下列因素中,对发生在溶液中且无气体参加的反应的速率不产生显著影响的是( )
A. 浓度B. 温度C. 压强D. 反应物的性质
科目:高中化学 来源: 题型:
【题目】把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )

① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,能大量共存的是离子组是 ( )
A.Mg2+、Fe2+、NO3-、SCN-B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3-D.Na+、Ba2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的5种短周期元素。A是最轻的金属,B的最低负化合价的绝对值比最高正化合价少2,C的简单阴离子C2-与氖原子有相同的电子层结构,D与A同主族,E的M层电子数比L层少2个。
(1)写出元素符号:A______、C______,E在元素周期表中的位置是________________;
(2)C、D、E原子半径由大到小:______(写元素符号,后同),C、D、E简单离子的半径由大到小_____;
(3)A常用作电池的电极材料,含A的电池通常采用非水电解质或固体电解质,原因是______(用化学方程式解释);
(4)B与氢元素可以形成10电子微粒X和18电子微粒Y,Y是一种良好的火箭燃料。X中含有的共价键类型是_______,Y的电子式为_________;
(5)C的两种单质在常温下都是气体,它们互为____________。比较C的氢化物和E的氢化物沸点:C___E(填“>”“<”或“=”),原因是____________
(6)用电子式表示D与E的二元化合物的形成过程:________________,碳原子与E能形成AB2型化合物,请写出该物质的电子式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:

已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是( )
A. 淀粉、油脂和蛋白质都是天然高分子化合物
B. 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
D. 从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成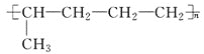 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 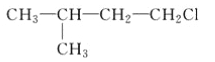 B.
B. 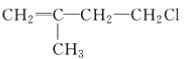 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 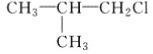
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
B.将CO2通入BaCl2溶液可生成BaCO3沉淀
C.将CO2通入次氯酸钙溶液可生成次氯酸
D.0.12g石墨中含有6.02×1022个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__________。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是__________,碱性最强的化合物的化学式是__________________。
(3)比较①与⑤的最高价氧化物对应的水化物,________________的酸性强(填化学式)
(4)工业上制取②的氢化物的化学方程式_______________________________________;
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为_____________。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________________________________________(用化学方程式表示)
(6)比较③与⑥的氢化物,_______________更稳定,__________沸点更高(填化学式)
(7)写出④的单质与水反应的化学方程式_________________________________________。
(8)写出⑦元素的离子结构示意图______________________,该离子半径_________S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com