
| A、9.35 g |
| B、12.6 g |
| C、13.6 g |
| D、15.8 g |
| 5.6L |
| 22.4L/mol |
| 5.6L |
| 22.4L/mol |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、78g苯中含有碳碳双键3NA个 |
| B、1mol甲基(-CH3)含有电子数为10NA个 |
| C、14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、在标准状况下,11.2L辛烷中的碳原子数为4 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| B、无色透明的溶液中:Ba2+、H+、MnO4-、Br- |
| C、使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- |
| D、能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组设计如图所示的电解装置,则下列说法中正确的是( )
某实验小组设计如图所示的电解装置,则下列说法中正确的是( )| A、实验要求所用的电极为纯度达到99.999%的铜,主要是为了防止阳极中的杂质活泼金属对实验结果造成影响 | ||
B、通电时Cu2+向A极区迁移,S
| ||
| C、实验过程中A极的电极反应式为Cu2++2e═Cu | ||
| D、实验结果显示,最终阴极区颜色加深,阳极区颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I
向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I| O | - 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清的溶液中:Na+、K+、MnO4-、AlO2- | ||
| B、滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32- | ||
C、
| ||
| D、c(I-)=0.1 mol?L-1的溶液中:Na+、H+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
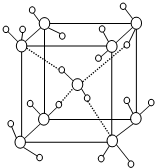 [化学-物质结构与性质]
[化学-物质结构与性质]查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com