
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)分析 除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,操作①为溶解后,②中加氯化钡除去SO42-,③中加NaOH除去Mg2+,④中加碳酸钠除去Ca2+及过量的氯化钡,⑤中操作B为过滤,过滤后,⑥中加盐酸,⑦为蒸发、结晶、烘干,得到精盐,以此来解答.
解答 解:(1)判断BaCl2已过量的方法是取第②步后的上层清液1~2滴于滴定板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,故答案为:取第②步后的上层清液1~2滴于滴定板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)第①步中,操作A是溶解,第⑤步中,操作B为过滤,
故答案为:溶解;过滤;
(3)第④步中,相应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;BaCl2+Na2CO3=BaCO3↓+2NaCl;
(4)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度,
故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;
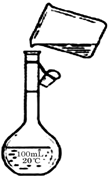
(5)配制250mL 0.2mol/L NaCl(精盐)溶液,由图可知未用玻璃棒引流、未采用250 mL容量瓶,故答案为:未用玻璃棒引流;未采用250 mL容量瓶.
点评 本题考查混合物分离提纯,为高频考点,把握粗盐提纯、物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
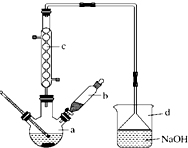 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | +2(a-b-c) kJ•mol-1 | B. | +2(b-a) kJ•mol-1 | ||
| C. | +(b+c-a) kJ•mol-1 | D. | +(a+b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | CH3COONa | Na2S |
| pH | 7.5 | 9.5 | 11.8 |
| A. | 根据如,NaF的水解程度比CH3COONa的大 | |
| B. | 同体积、同pH的两种酸溶液消耗同浓度NaOH的体积:HF>CH3COOH | |
| C. | 向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况):c(CH3COOH)+c(H+)═c(OH-)+c(F-) | |
| D. | 若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,则溶液中离子浓度大小为:c(Cl-)>c(HS-)>c(OH-)c(S2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:
W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com