
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目小于0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度为3 mol/L |
分析 A.求出钠的物质的量,然后根据钠与氧气的产物无论是氧化钠还是过氧化钠中,均有2mol钠离子、1mol阴离子来分析;
B.一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C.H218O与D2O的摩尔质量均为20g/mol;
D.Al3+是弱碱阳离子,在溶液中会水解.
解答 解:A.4.6g钠的物质的量为:$\frac{4.6g}{23g/mol}$=0.2mol,而Na与氧气的产物无论是氧化钠还是过氧化钠中,均有2mol钠离子、1mol阴离子,故0.2mol钠离子、0.1mol阴离子,即含有的阴阳离子的总数为0.3NA个,故A正确;
B.氢氧化铁胶粒为多个氢氧化铁的聚集体,故0.5mol氯化铁形成的胶粒的个数小于0.5NA个,故B正确;
C.H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为:$\frac{2.0g}{20g/mol}$=0.1mol,而1molH218O与D2O均含10个中子,故0.1mol混合物中含1mol中子,含有中子数为NA,故C正确;
D.Al3+是弱碱阳离子,在溶液中会水解,故当含NA个Al3+时,溶液NO3-物质的量大于3 mol,其浓度大于3mol/L,故D错误;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度不大,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等之间的关系,B为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
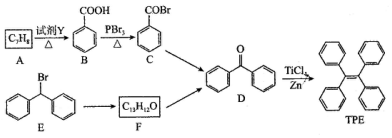
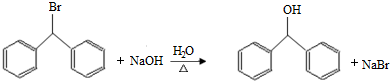 .
.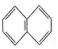 )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式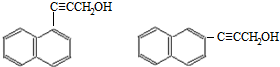 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的变化 | 平衡时NH3的体积分数 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ | W1 |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q kJ | W2 |
| A. | W1>W2,Q<23.15 | B. | W1=W2,Q=23.15 | C. | W1<W2,Q>23.15 | D. | W1=W2,Q<23.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 化石燃料在任何条件下都能充分燃烧 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 弱酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
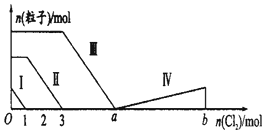 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )| A. | 线段Ⅲ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=1:3 | ||
| C. | 线段Ⅳ表示IO4-的变化情况 | D. | 根据图象可以计算a的值为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | |
| B. | 平衡时气体压强是原来压强的1.1倍 | |
| C. | A的平衡浓度是1.4 mol•L-1 | |
| D. | B的转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可以证明胶体粒子带电 | |
| C. | 丁达尔效应是溶液与胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸和半透膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
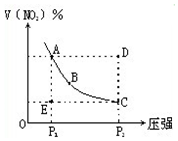 对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )
对于反应N2O4?2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).下列说法正确的是( )| A. | A、C两点的正反应速率的关系A>C | |
| B. | A、B、C、D、E各状态,V正>V逆的是状态D | |
| C. | 使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从P1突然加压至P2 | |
| D. | 维持P1不变,E→A所需时间为x,维持P2不变,D→C所需时间为y,则x<y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com