
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
分析 含有一个六元碳环且能与NaHCO3溶液反应生成二氧化碳,则A中含有-COOH,有机物A完全燃烧后只生成二氧化碳和水,说明没有碳氢氧以外的元素,A的相对分子质量为128的,A含有一个六碳环,6个碳原子式量为72,-COOH的式量为45,故分子含有1个-COOH,利用残余法可知,剩余基团或原子的总式量为128-72-45=11,故还原11个H原子,A的结构简式为 ,据此分析.
,据此分析.
解答 解:A含有一个六元碳环且能与NaHCO3溶液反应生成二氧化碳,则A中含有-COOH,有机物A完全燃烧后只生成二氧化碳和水,说明没有碳氢氧以外的元素,A的相对分子质量为128的,A含有一个六碳环,6个碳原子式量为72,-COOH的式量为45,故分子含有1个-COOH,利用残余法可知,剩余基团或原子的总式量为128-72-45=11,故还原11个H原子,A的结构简式为 ,环上的取代物,除了-COOH的邻、间、对位置外,羧基连接的碳也还有氢原子,可以取代,故其环上的一溴代物有4种,
,环上的取代物,除了-COOH的邻、间、对位置外,羧基连接的碳也还有氢原子,可以取代,故其环上的一溴代物有4种,
故选B.
点评 本题考查同分异构体、有机物的推断等,注意残余法确定有机物的结构是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
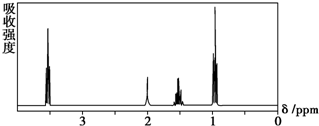
| A. | CH3CH2CH2CH3 | B. | (CH3)2CHCH3 | C. | CH3CH2CH2OH | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和纳米管互为同分异构体 | B. | N5和N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | C原子半径比N原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | 物质A的转化率增大了 | ||
| C. | 物质A的质量分数减小了 | D. | 平衡向逆反应方向移动了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
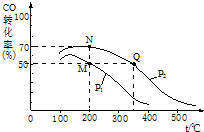 减少污染、保护环境是全世界最热门的课题.
减少污染、保护环境是全世界最热门的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O和C4H10O | B. | C3H6O2和C4H8O2 | C. | C4H10和C10H22 | D. | C3H4和C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
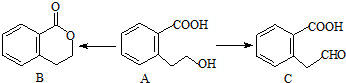
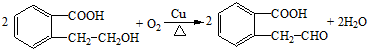 .
.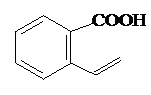 或
或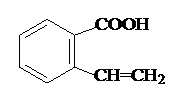 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能和Ca2+生成沉淀的溶液中:Ba2+、K+、CH3COO-、Cl- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 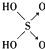 | 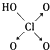 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
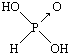 和
和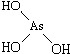 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com