
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届湖北省高三5月模拟四理综化学试卷(解析版) 题型:简答题
以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
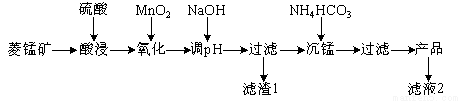
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
①Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
②“沉锰”前溶液中c(Mn2+)= mol·L-1。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。
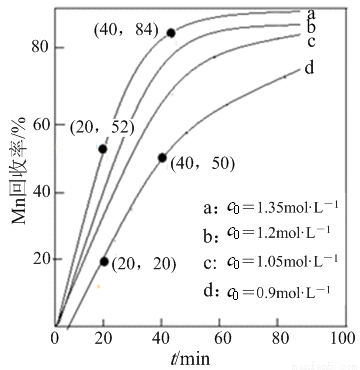
①NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等体积1.8 mol·L-1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+)= 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三高考打靶测试理综化学试卷(解析版) 题型:选择题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
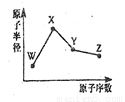
A.对应简单离子半径:W>X
B.对应气态氢化物的稳定性:Y<Z
C.化合物XZW既含离子键,又含极性共价键
D.Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:选择题
X的分子式为C5H12O,能与金属钠反应产生氢气,X还能与相对分子质量相同的羧酸Y生成酯Z,则有机物Z有(不含立体异构)( )
A.64种 B.16种 C.8种 D.32种
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三考前热身理综化学试卷(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
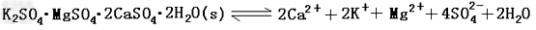
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
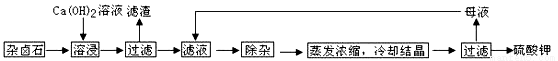
(1)滤渣主要成分有_______和_______以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
____ 。
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入_______溶液调滤液PH至中性。
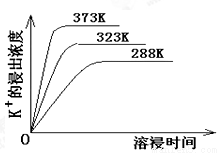
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高,
①________________________②_______________
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
 已知298K时,Ksp(CaCO3)
已知298K时,Ksp(CaCO3)
=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:实验题
实验题:绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下列是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法。

已知:室温下饱和 H2S溶液的 pH 约为3.9,SnS沉淀完全时溶液的 pH 为1.6;FeS开始沉淀时溶液的 pH 为3.0,沉淀完全时的 pH 为5.5。
(1) 操作Ⅱ,在溶液中用硫酸酸化至 pH=2的目的是_______________________。
(2)操作Ⅳ的顺序依次为________、________、过滤、洗涤、干燥。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②________________________________________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是
a.称取一定质量的绿矾产品,配制成250.00 mL溶液;
b.量取25.00 mL 待测溶液于锥形瓶中;
c.用硫酸酸化的 0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
①用硫酸酸化的 0.010 00 mol·L-1 KMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化判断此滴定实验达到终点的方法是___________________;
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有___ _。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.向硫酸铝溶液中加入少量的氨水:Al3++3OH-=Al(OH) 3↓
B.向碳酸钠溶液中加入饱和石灰水:Ca(OH)2 +CO32-=CaCO3↓+2OH-
C.向氢氧化钠溶液中通入过量的氯气:Cl2+2OH-=ClO-+Cl-+H2O
D.向稀硫酸中加入过量铁粉,先后发生两个反应:2Fe+6H+=2Fe3+ +3H2↑,Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
缬氨霉素(valinomycin)是一种脂溶性的抗生素,是由12个分子组成的环状化合物,它的结构简式如图所示,有关说法正确的是
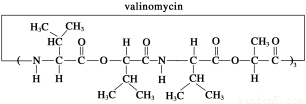
A.缬氨霉素是一种蛋白质
B.缬氨霉素完全水解可得到四种氨基酸
C.缬氨霉素完全水解后的产物中有两种产物互为同系物
D.缬氨霉素完全水解,其中一种产物与甘油互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:实验题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
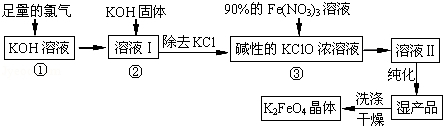
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.写出在温度较高时KOH 与Cl2反应的化学方程式 ;
(2)在反应液I中加入KOH固体的目的是 (填编号);
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42﹣+ H2O= Fe(OH)3(胶体)+ O2↑+
完成并配平上述反应的离子方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com