
分析 ①碳酸钠在溶液中水解生成碳酸氢根离子和氢氧根离子;根据方程式书写平衡常数,水不写入平衡常数中;
②计算碳酸氢钠溶液中的水解平衡常数与电离常数,比较二者的大小;
③溶液为中性,则c(H+)=10-7mol/L,根据K=$\frac{c(HC{{O}_{3}}^{-})×c({H}^{+})}{c({H}_{2}C{O}_{3})}$计算.
解答 解:①碳酸钠在溶液中水解生成碳酸氢根离子和氢氧根离子,其水解方程式为:CO32-+H2O?HCO3-+OH-;其平衡常数K的表达式为:K=$\frac{c(HC{{O}_{3}}^{-})×c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$;
故答案为:CO32-+H2O?HCO3-+OH-;K=$\frac{c(HC{{O}_{3}}^{-})×c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$;
②碳酸氢钠溶液中,水解方程式为:HCO3-+H2O?H2CO3+OH-;则水解平衡常数Kh=$\frac{{K}_{W}}{{K}_{1}}$=$\frac{1{0}^{-14}}{4×1{0}^{-7}}$mol/L=2.5×10-8 mol/L,HCO3-的电离常数K2=4.7×10-11,水解常数大于电离常数,所以溶液中以水解为主,因此溶液显碱性;
故答案为:碳酸氢钠溶液中的水解平衡常数Kh=$\frac{{K}_{W}}{{K}_{1}}$=$\frac{1{0}^{-14}}{4×1{0}^{-7}}$mol/L=2.5×10-8 mol/L,大于碳酸的电离常数K2=4.7×10-11;
③溶液为中性,则c(H+)=10-7mol/L,K=$\frac{c(HC{{O}_{3}}^{-})×c({H}^{+})}{c({H}_{2}C{O}_{3})}$=4.4×10-7,则$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=4.4;
故答案为:4.4.
点评 本题考查了盐的水解、水解常数的计算、电离常数的计算等,题目难度中等,侧重于考查学生对基础知识的应用能力和计算能力,注意把握电离常数与水解常数的计算方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 一定产生了乙烯 |
| D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液 | 溶液褪色 | CaCl2溶液有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
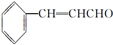 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成: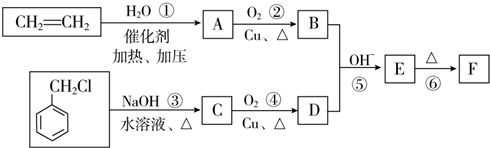
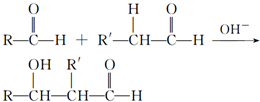
 ,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.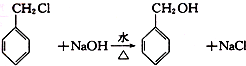 .
.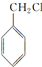 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).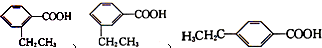 三种任写一种即可.
三种任写一种即可.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 问题 | 评价 |
| A | 用稀硝酸清洗做过银镜反应的试管 Ag+4H++NO3-=Ag++NO↑+2H2O | 错误,物质拆分错误 |
| B | 离子组 Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为发生反应: HCO3-+OH-=H2O+CO2↑ |
| C | 反应: Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq) | 该反应的平衡常数表达式:K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ |
| D | 在硫酸氢钠溶于水的过程中 | 只有离子键被破坏没有共价键被破坏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y的最高价氧化物的水化物之间不能反应 | |
| B. | 简单离子半径的大小顺序:rX>rY>rW>rQ | |
| C. | 工业上常用电解的方法制备X、Y的单质 | |
| D. | 元素Q和Z能形成QZ2型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离苯和己烷--分液 | |
| B. | NO(NO2)--通过水洗、干燥后,用向下排气法收集 | |
| C. | 乙烷(乙烯)--让气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(乙酸)--加足量NaOH溶液,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R不是主族元素 | B. | R是第六周期元素 | ||
| C. | R的原子核内有63个质子 | D. | R的一种同位素的核内有89个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com