
常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是( )
| 共价键 | H—H | F—F | H—F | H—Cl | H—I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g)===2HF(g)
ΔH=-25 kJ·mol-1
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
在密闭容器发生下列反应aA(g)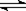 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO +16H++5Na2O2===2Mn2++5O2↑+8H2O+10Na+。下列判断正确的是( )
+16H++5Na2O2===2Mn2++5O2↑+8H2O+10Na+。下列判断正确的是( )
A.Na2O2既是氧化剂,又是还原剂
B.O2是还原产物,Mn2+是氧化产物
C.通常用浓盐酸酸化高锰酸钾溶液
D.标准状况下,产生22.4 L O2时反应转移2 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铁及其化合物的离子方程式一定错误的是( )
A.氢氧化铁与氢碘酸反应:Fe(OH)3+3H+===Fe3++3H2O
B.铁与稀硝酸反应:Fe+4H++NO ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
C.磁性氧化铁与浓盐酸反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
D.溴化亚铁溶液与氯水反应:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知还原性:HSO >I-,氧化性:IO
>I-,氧化性:IO >I2。
>I2。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并标出电子转移的方向和数目。
□NaIO3+□NaHSO3―→□I2+□Na2SO4+□H2SO4+□H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全,推测反应后溶液中的还原产物为________________(填化学式)。
(3)在含5 mol NaHSO3的溶液中逐滴加入NaIO3溶液,加入NaIO3的物质的量和析出I2的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式____________;当溶液中I-与I2的物质的量之比为53时,加入的NaIO3为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g)2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
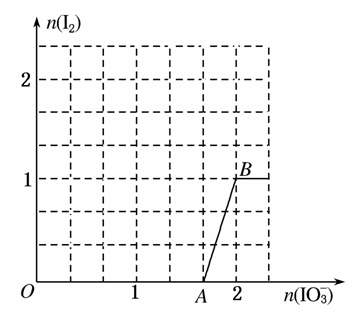
用如图装置进行实验(A为电流计):
观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是( )
A.图1是电解池,图2是原电池
B.两个电池中,电子均由Cr电极流向Cu电极
C.图2中Cr电极可能被浓HNO3钝化成惰性电极
D.由实验现象可知金属活动性:Cu>Cr
查看答案和解析>>
科目:高中化学 来源: 题型:
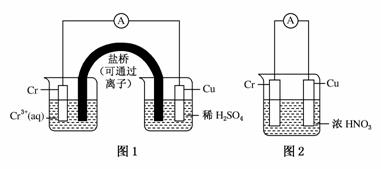
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是______________________________________________________________。
(4)Y与Z可形成YZ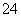 。
。
①YZ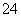 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
②写出一种与YZ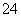 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
例海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
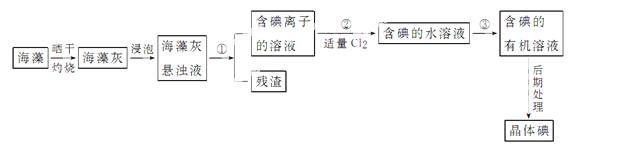
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;写出实验②中有关反应的离子方程式_______。
(2)提取碘的过程中,可供选择的有关试剂是 。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(3)从海藻灰中碘离子转化到碘的有机溶液,实验室准备了烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。如右图所示,还缺少的玻璃仪器是________。
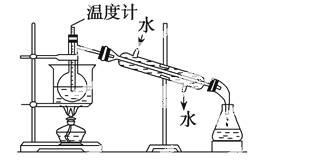
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:①_______, ② ,③ 。
(5)进行上述蒸馏操作时,使用水浴的原因是 ;最后,晶体碘在 里聚集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com