
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
分析 A.无色气体可能为二氧化硫;
B.白色沉淀可能为AgCl;
C.滴入紫色石蕊试液显红色,溶液显酸性;
D.先加硝酸排除干扰离子,再加硝酸银生成的白色沉淀为AgCl.
解答 解:A.无色气体可能为二氧化硫,则固体可能为碳酸盐、碳酸氢盐、亚硫酸盐、亚硫酸氢盐等,故A错误;
B.白色沉淀可能为AgCl,则原溶液可能含银离子或硫酸根离子,但二者不同时存在,故B错误;
C.因石蕊遇酸变红,滴入紫色石蕊试液显红色,溶液显酸性,故C错误;
D.先加硝酸排除干扰离子,再加硝酸银生成的白色沉淀为AgCl,则证明含Cl-,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、试剂的选择及反应现象等为解答的关键,侧重分析与实验能力的考查,注意离子检验中排除干扰离子,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向新制的氯水中加KI?淀粉溶液即可证明 | |
| B. | 向久置失效的氯水中加KI?淀粉溶液即可证明 | |
| C. | 直接观察氯水溶液仍显黄绿色即可说明,不需进一步实验 | |
| D. | 用实验证明干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS 沉淀中滴加CuSO4 溶液可以得到CuS 沉淀 |
| B | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| C | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| D | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
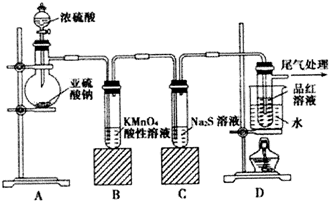
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
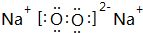 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将溴水加入苯中 | 溴水颜色变浅 | 苯与溴水发生取代反应 |
| B | 将SO2通入到Ba(NO3)2溶液中 | 有白色沉淀 | 沉淀成分为BaSO3 |
| C | 等体积、等PH的HA和HB两种溶液分别与足量的锌反应 | 相同时间内,HA酸产生的氢气多 | HA为强酸 |
| D | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置 | 下层液体呈紫色 | Br2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
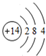 .
. ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com