
| A. | SO2、SO3都是极性分子 | |
| B. | 在NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 非金属元素原子之间也可能形成离子化合物 |
分析 A.SO3是平面三角形,是极性键形成的非极性分子;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键;
C.根据电负性的概念分析;
D.氯化铵是由非金属元素形成的离子化合物.
解答 解:A.SO2是极性分子,SO3分子是非极性分子,所以二者分子的极性不同,故A错误;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键,故B正确;
C.元素电负性是表示对键合电子的吸引力的大小,电负性越大对键合电子吸引力越大,故C正确;
D.氯化铵是由非金属元素形成的离子化合物,故D正确;
故选A.
点评 本题考查了极性分子和非极性分子的判断方法,配位键,电负性等概念,难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ⑧② | B. | ⑥①⑤③ | C. | ④② | D. | ⑦①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有极性键的化合物分子内一定不含有非极性键 | |
| B. | 分子内两种非金属元素的原子之间形成的化学键是极性键 | |
| C. | 离子化合物中一定含有金属阳离子和离子键 | |
| D. | 两种元素构成的共价化合物分子中的化学键一定都是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
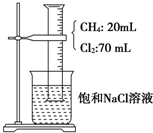 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的烧杯中进行实验,对实验现象及产物分析中错误的是( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的烧杯中进行实验,对实验现象及产物分析中错误的是( )| A. | 混合气体的颜色变浅,量筒中液面上升 | |
| B. | 量筒内壁上出现的油状液滴,应是三氯甲烷、四氯甲烷的混合物 | |
| C. | 烧杯中有白色固体物质析出 | |
| D. | 甲烷与氯气反应后的产物只有CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12753I2和12953I2互为同位素 | |
| B. | 氢氧化钠的电子式 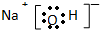 | |
| C. | 氯原子的结构示意图: | |
| D. | 中子数为146、质子数为92的铀(U)原子${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{19}^{40}K$与${\;}_{20}^{40}Ca$ | B. | D2O与T2O | ||
| C. | ${\;}_{19}^{40}K$与${\;}_{19}^{39}K$ | D. | 白磷与红磷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com