
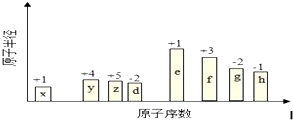
| 元素 | 元素性质或原子的结构 |
| T | 2p轨道能级电子数比s能级电子数多1个 |
| X | L层p能级电子数比s能级电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有3个未成对电子 |
 .写出元素Z的简单气态氢化物的电子式:
.写出元素Z的简单气态氢化物的电子式: .
.分析 T元素的2p轨道能级电子数比s能级电子数多1个,1s、2s能级电子数为2×2=4,则2p轨道的电子数为4+1=5,故T为N元素;X的L层p能级电子数比s电子数多2个,核外电子排布为1S22S22P4,为O元素;Y是第三周期元素的简单离子中半径最小元素,则Y为Al元素;Z的L层有3个未成对电子,即2p轨道上有3个电子,其电子排布式为:1s22s22p3,则Z为N元素,据此进行解答.
1s22s22p5
解答 解:T元素的2p轨道能级电子数比s能级电子数多1个,1s、2s能级电子数为2×2=4,则2p轨道的电子数为4+1=5,故T为N元素;X的L层p能级电子数比s电子数多2个,核外电子排布为1S22S22P4,为O元素;Y是第三周期元素的简单离子中半径最小元素,则Y为Al元素;Z的L层有3个未成对电子,即2p轨道上有3个电子,其电子排布式为:1s22s22p3,则Z为N元素,
(1)元素X为O,氧离子的核电荷数为8,核外电子总数为10,其离子结构示意图为: ;元素Z为N,其简单气态氢化物为氨气,氨气为共价化合物,氨气中存在3个氮氢键,氮原子最外层达到8电子稳定结构,其电子式为
;元素Z为N,其简单气态氢化物为氨气,氨气为共价化合物,氨气中存在3个氮氢键,氮原子最外层达到8电子稳定结构,其电子式为 ,
,
故答案为: ;
; ;
;
(2)元素Y的最高价氧化物对应的水化物为氢氧化铝,氢氧化铝与KOH反应的化学方程式为:KOH+Al(OH)3=KAlO2+2H2O,
故答案为:KOH+Al(OH)3=KAlO2+2H2O;
(3)T、Y、Z三种元素分别为F、Al、N元素,其中Al为金属,其它两种为非金属,所以T、Y、Z三种元素的单质中化学性质明显不同于其他单质的是Al;
元素F与氯化素相比,非金属性较强的是F,
a.常温下氯气的颜色比T单质的颜色深,根据单质颜色无法判断F、Cl的非金属性,故a错误;
b.T的单质为氟气,氟气通入氯化钠水溶液中,氟气与水反应生成氟化氢和氧气,无法证明二者非金属性强弱,故b错误;
c.氯与F形成化合物中,氯元素呈正价,说明F元素的得电子能力更强,则F的非金属性大于Cl,故c正确;
故答案为:Al;F;c.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,根据题干信息正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析、理解能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应 | |
| B. | 氧化物中都含有氧元素,则含有氧元素的化合物一定是氧化物 | |
| C. | 碱溶液的pH>7,则pH>7的溶液一定是碱的溶液 | |
| D. | 点燃H2和O2的混合气体可能发生爆炸,则H2点燃前须检验纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
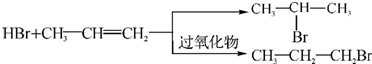
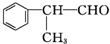 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{CH_{3}-CH=CH_{2}}^{①催化剂}$
$→_{CH_{3}-CH=CH_{2}}^{①催化剂}$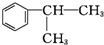 $→_{Br_{2}}^{②光照}$A(一溴代物)$\stackrel{③}{→}$B$→_{HBr}^{④加成反应}$C$\stackrel{⑤}{→}$ D$\stackrel{⑥氧化反应}{→}$
$→_{Br_{2}}^{②光照}$A(一溴代物)$\stackrel{③}{→}$B$→_{HBr}^{④加成反应}$C$\stackrel{⑤}{→}$ D$\stackrel{⑥氧化反应}{→}$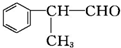
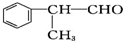 含有的官能团的名称为醛基.
含有的官能团的名称为醛基.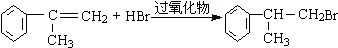 (有机物写结构简式,并注明反应条件,下同).
(有机物写结构简式,并注明反应条件,下同).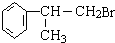 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$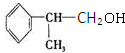 +NaBr.
+NaBr.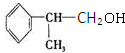 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.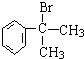 的水解产物
的水解产物 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.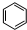 +HNO3$→_{50-60℃}^{浓硫酸}$
+HNO3$→_{50-60℃}^{浓硫酸}$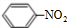 +H2O,反应类型取代反应.
+H2O,反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
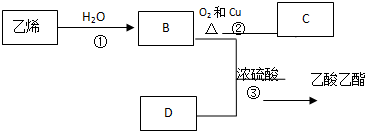
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、NH4+、CO32-、Cl-可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 与Na2S反应的离子方程式:Al3++S2-→Al2S3↓ | |
| D. | 与过量浓氨水反应的离子方程式:Al3++3NH3+3H2O→Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
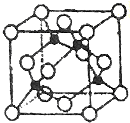 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| B. | 淀粉、油脂和蛋白质都能发生水解反应 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 蛋白质既能与酸反应又能与碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com