
(10分)下图所示是用于气体制备、干燥(或除杂质)、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用)。请根据下列要求回答问题。
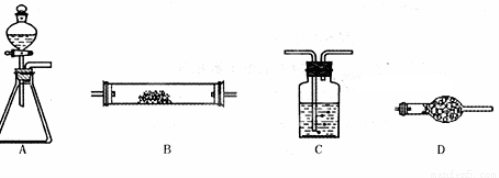
(1)若用A-C-D-B组合进行氢气还原氧化铜实验。分液漏斗中的试剂是盐酸,C中试剂是水,其作用是 ;A中反应开始一段时间后,再加热B。加热B之前的实验操作是 。
(2)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A-C-B-D连接成实验装置体系。A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是 (填名称);C中试剂是 (填名称)。已知高锰酸钾反应生成+2价的锰离子,写出此法制备氯气的离子方程式 。
(3)为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是 ;(填字母)装置B中发生反应的化学方程式为 。
(1)吸收氢气中的HCl (或除去HCl)(1分) ; 检验氢气纯度 (或验纯H2) (1分);
(2)浓盐酸(1分);浓硫酸 (1分); 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O(2分);
(3)A、D、B、D (D盛装碱石灰)或A、D、B、C(C盛装氢氧化钠溶液) ;(2分)
4NH3+5O2 4NO+6H2O (2分)
4NO+6H2O (2分)
【解析】
试题分析:(1)若用A-C-D-B组合进行氢气还原氧化铜实验。分液漏斗中的试剂是盐酸,由于盐酸有挥发性,使用制取的氢气中含有杂质气体HCl,C中试剂是水,其作用是吸收氢气中的HCl (或除去HCl);A中反应开始一段时间,当整个装置充满H2后,再加热B,否则会发生爆炸。加热B之前的实验操作是检验氢气纯度 (或验纯H2);(2)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A-C-B-D连接成实验装置体系。A锥形瓶中试剂选用高锰酸钾晶体,高锰酸钾有强氧化性,则分液漏斗中的液体是含有氯元素而且有强还原性的浓盐酸;C中试剂是干燥氯气的干燥剂浓硫酸。已知高锰酸钾反应生成+2价的锰离子,则此法制备氯气的离子方程式是2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;(3)为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接应该是制取气体装置、干燥装置、性质验证、尾气处理,则装置的连接顺序是A、D、B、D (D盛装碱石灰)或A、D、B、C(C盛装氢氧化钠溶液)。装置B中发生反应的化学方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。
考点:考查关于气体的制取化学反应原理、操作方法、连接顺序、方程式的书写的知识。


科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
设阿伏加德罗常数为NA,下列说法正确的是( )
A.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
B.常温常压下,14g氮气中含有 NA个原子
C.1mol/LNaCl溶液中含有NA个氯离子
D.等质量的丙烯和乙烯气体中氢原子的个数均为6NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省七校高三上学期第一次联考理综化学试卷(解析版) 题型:填空题
(16分)成环是有机合成的重要环节。如反应
①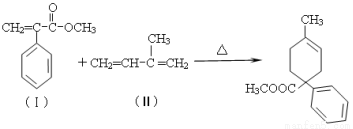
化合物(Ⅰ)可由(Ⅲ)合成:

(1)(Ⅰ)的分子式为 ,1mol(Ⅰ)最多能与 mol H2发生加成反应。
(2)写出(Ⅳ)→ A的化学方程式 。
(3) 酸性条件下,化合物B能发生聚合反应,化学方程式为 。
(4)化合物B→(Ⅴ)的反应类型为 。
(5)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为______ (任写一种)
(6)下列物质与(Ⅴ)互为同分异构体的是 (填序号)
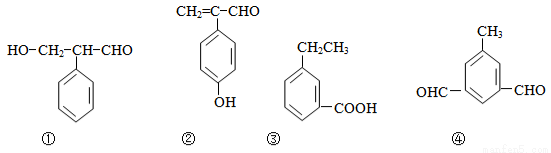
查看答案和解析>>
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:选择题
将下图中所示实验装置的K闭合,下列判断正确的是
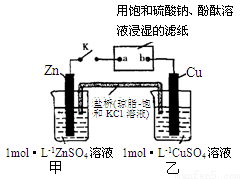
A.电子沿Zn→a→b→Cu路径流动
B.Cu电极上发生氧化反应
C.甲池与乙池中的溶液互换,闭合K仍有电流产生
D.片刻后可观察到滤纸a点变红色
查看答案和解析>>
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,1.8 g H2O所含有的质子数为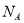
B.1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为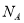
C.25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2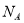
D.标准状况下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.2 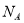
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:填空题
(6分) 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式___________________________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的 ______曲线表示(填序号)。
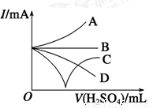
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是
A.硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O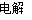 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.冷的氢氧化钠溶液中通入氯气:Cl2+2OH-===ClO-+Cl-+H2O
D.碳酸钙与醋酸溶液反应 CaCO3 +2H+ = Ca2+ +CO2 ↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:填空题
(8分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________ 。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2 B.Fe C.H2O2 D.HNO3
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
(12分)A+B→X+Y+ H2O(为配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是______.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol.
(4)若A、B、X、Y均为化合物.A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则向A中逐滴加入B的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com