
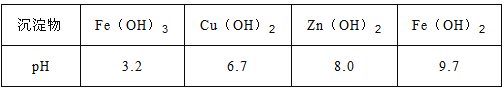
����Ŀ����������п�������Ļ��Լ�����ǿ����������п��Ʒ�������������CuO��SiO2�����ʣ�Ϊԭ���Ʊ���������п��������������Ʒ��������������������
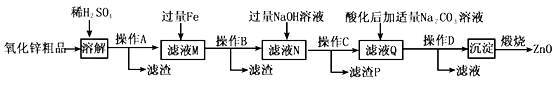
��֪��Zn(OH)2������NaOH��Һ��һЩ������������������ʽ��ȫ����ʱ��Һ��pH���±���
��1������A���õIJ����������ձ���©����______________��
��2�����ܽ⡱ǰ������п��Ʒ�����ϸ������Ŀ����____________________��
��3������������ɻ��յĽ�����_______________��
��4��������������ҺN�м���������H2O2��Һ���ټ�һ����ij�Լ�������ҺpH=5����Fe3+Ũ��Ϊ__________����֪Ksp[Fe(OH)3]=4.0��10-34��
��5����K3[Fe(CN)6]�����軯�أ���֤N��Fe2+��������___________��
��6�����������ijɷ�ΪZnCO3��2Zn(OH)2��H2O�������ա���450��500���½��У����ջ��ZnO�ķ�Ӧ�Ļ�ѧ����ʽΪ_____________________��
��7��ȡ20.00mL�˶�N����0.02mol/L��KMnO4��Һ���еζ�������KMnO4��Һ18.00mL������ҺN��Fe2+��Ũ��Ϊ__________________��
���𰸡���1������������2�������Һ�Ӵ�������ӿ��ܽ�ʱ�ķ�Ӧ���ʣ���3��Cu��
��4��c(Fe3+)=4.0��10-7mol/L����5������ɫ�������ɣ�
��6��ZnCO3��2Zn(OH)2��H2O![]() 3ZnO��3H2O��CO2������7��0.09mol/L
3ZnO��3H2O��CO2������7��0.09mol/L
��������
������������������Ϣ�ͻ�ѧ��������֪������п��Ʒ�������������CuO��SiO2�����ʣ���ϡ�������ܽ���������ͭ������п��������������������������A���ˣ������ijɷ�Ϊ�������裻����ҺM�м����������������������Ӧ����������������������ͭ��Ӧ��������������ͭ�����˵���������ͭ�Ļ�����ҺNΪ��������������п�Ļ�������ҺN�мӹ�������������Һ����Ԫ��ת��Ϊ����������������ˣ�����P����Fe(OH)2��Fe(OH)3����ҺQ�ữ�����̼������Һ��пԪ��ת��Ϊ���������յ�����п��
��1������A�ǹ��ˣ����õIJ����������ձ���©������������
��2�����ܽ⡱ǰ������п��Ʒ�����ϸ��������Ŀ��������Ӵ����ʹ���ܳ�ַ�Ӧ��
��3���������Ϸ�����֪����������ɻ��յĽ���ͭ��
��4��pH=5ʱ��Һ��������Ũ����10��9mol/L��������Һ��������Ũ�ȣ�![]() ��4.0��10-7mol/L��
��4.0��10-7mol/L��
��5����K3[Fe(CN)6]�����軯�أ���֤N��Fe2+������������ɫ�������ɣ�
��6�����������ijɷ�ΪZnCO3��2Zn(OH)2��H2O���������յķ���ʽΪZnCO3��2Zn(OH)2��H2O![]() 3ZnO��3H2O��CO2����
3ZnO��3H2O��CO2����
��7�����ݵ���غ��֪��ҺN��Fe2+��Ũ����![]() ��0.09mol/L��
��0.09mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����еķ�Ӧ������ͬһ��Ӧ���͵���( )
A���������ˮ���Ʊ������ɱ�ϩ��ˮ��Ӧ�Ʊ���
B���ɼױ������ƶ������ױ����ɼױ������Ʊ�����
C������ȩ���Ҵ�������ȩ������
D����������Ҵ��������������ɱ���������ˮ���Ʊ�������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��ǰ������ȡ����Ӧ���������ڼӳɷ�Ӧ���ǣ� ��
A. ���ռ����������Ļ�����ϩʹ���Ը��������Һ��ɫ
B. ![]() ����ϩ��ˮ������һ�����������Ҵ�
����ϩ��ˮ������һ�����������Ҵ�
C. ��ϩʹ������Ȼ�̼��Һ��ɫ ������������һ�������·�Ӧ���ɻ�����
D. �ڱ��е�����ˮ����ˮ��ɫ �� ��ϩʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2BrO3��+Cl2=Br2+2ClO3��
��5Cl2+I2+6H2O=2HIO3+10HCl
��ClO3��+5Cl��+6H+=3Cl2+3H2O������������������ǿ��˳����ȷ���ǣ� ��
A. ClO3����BrO3����IO3����Cl2 B. BrO3����ClO3����Cl2��IO3��
C. Cl2��BrO3����ClO3����IO3�� D. BrO3����Cl2��C1O3����IO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
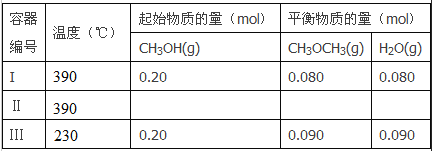
����Ŀ��һ���¶��£������������Ϊ2L�ĺ����ܱ������з�����Ӧ��
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
�ش��������⣺
��1����Ӧ����H_________O �����������������������жϵ�������_____________������I����ƽ�������ʱ��Ϊ20s����Ӧ����v(CH3OH)Ϊ_________mol/(L��s)��390��ʱ�÷�Ӧ��ƽ�ⳣ��K1=________������ֵ����
��2������II��ƽ��ʱ��ѹǿ������I��������CH3OH���������������I�е���ͬ��CH3OH��ʼ�����ʵ���Ϊ__________��ƽ��ʱCH3OH(g)���������Ϊ___________��
��3��t���Ӻ�����III�ﵽƽ�⣬t_________20s������>����<������=�������жϵ�������________��
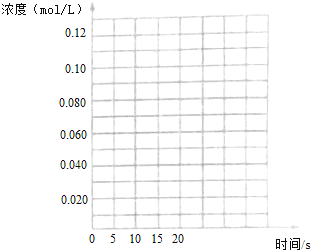
������ͼ�зֱ�����I������III��CH3OH(g)Ũ�ȱ仯������ʾ��ͼ��
��4��390��������3L�����г���0.9mol CH3OH(g), 0.6mol CH3OCH3(g)��0.3molH2O(g)������ʼʱ�÷�Ӧ����V��_________V�档������>����<������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6molX�����0.4molY��������2L�����У�ʹ���Ƿ������·�Ӧ��3X������ �� Y������ = nZ������ �� 2W������ 5minĩ������0.2molW������֪��ZŨ�ȱ仯����ʾ�ķ�Ӧƽ������Ϊ0.02mol/��L��min����
��1����Ӧ��Z����ļ�����n��
��2����Ӧ��5 minĩʱ��Y��ת���ʣ�
��3��ǰ5 min��XŨ�ȱ仯����ʾ�ķ�Ӧƽ������Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ƽ�� Zn �� HNO3����ϡ�� == Zn��NO3��2 �� NH4NO3 �� H2O
��2��д��ʵ������ȡNH3�Ļ�ѧ����ʽ�� ��
��3����ȥһ�������е�����������������÷������÷���ʽ��ʾ�� ��
��4���ں�Cu����ø���������Ļ���ģ��������������NO2������ת��ΪNO��д��Cu��������ˮ��Һ����NO2����Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ը��������Һ�м���������Ʒ�ĩ����Һ��ɫ�����з�����Ӧ�����ӷ���ʽΪ��2MnO![]() +16H++5Na2O2�T2Mn2++5O2��+8H2O+10Na+�������ж���ȷ�ģ� ��
+16H++5Na2O2�T2Mn2++5O2��+8H2O+10Na+�������ж���ȷ�ģ� ��
A��Na2O2���������������ǻ�ԭ��
B��O2�ǻ�ԭ���Mn2+����������
C��ͨ����Ũ�����ữ���������Һ
D����״���£�����22.4 L O2ʱ��Ӧת��2 mol e��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeBr2��FeI2�Ļ����Һ��ͨ��������������Һ��ijЩ���ӵ����ʵ����仯��ͼ��ʾ�������й�˵���в���ȷ���ǣ� ��
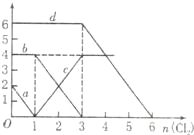
A��d���ߴ�����Һ��Br���仯���
B��ԭ��Һ��FeI2�����ʵ���Ϊ2mol
C��ԭ��Һ��n��Fe2+����n��Br����=2��3
D����ͨ��2mol Cl2ʱ����Һ�����ӷ�ӦΪ��2Fe2++2I��+2Cl2�T2Fe3++I2+4Cl��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com