
【题目】如图是中学化学中常用于混合物的分离和提纯的装置。
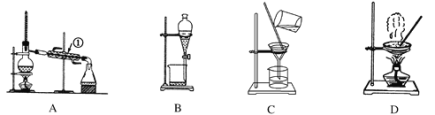
利用以上装置,可以按以下实验方案从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。(已知甲苯和甲醇均为有机溶剂,有机物大多能互溶)

(1)装置A中仪器①的作用是________,使用装置A的操作是_____(填“a”、“b”、“c”或“d”,下同)。
(2)使用装置B的操作是______,为使其中液体顺利滴下,除打开下端活塞外,还应进行的具体操作是___________________。
(3)使用装置C的操作是_______,若所得沉淀不溶于水且需要洗涤,则洗涤的具体操作是________________________________________________________________________________。
(4)使用装置D的操作是_______。
【答案】冷凝db将分液漏斗上部的玻璃塞打开a往漏斗中加水至没过沉淀,让水自然流干,重复加水2-3次c
【解析】
操作a是分离固液混合物,其操作为过滤,操作b是分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;操作c是从溶液中得到固体,操作为蒸发,需要蒸发皿;操作d是从有机化合物中,利用沸点不同采取蒸馏得到甲苯。据此解答。
(1)装置A中仪器①是冷凝管,其作用是冷凝。装置A是蒸馏装置,根据以上分析可知使用装置A的操作是d。
(2)装置B是分液,根据以上分析可知使用装置B的操作是b。为使其中液体顺利滴下,需要保持内外压强相等,因此除打开下端活塞外,还应进行的具体操作是将分液漏斗上部的玻璃塞打开。
(3)装置C是过滤,根据以上分析可知使用装置C的操作是a。若所得沉淀不溶于水且需要洗涤,洗涤时应该在过滤器中进行,则洗涤的具体操作是往漏斗中加水至没过沉淀,让水自然流干,重复加水2~3次。
(4)装置D是蒸发,则根据以上分析可知使用装置D的操作是c。


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表的第IIA族
B.H2O比H2S稳定是因为H2O分子间有氢键
C.离子化合物中可能含有共价键
D.因为盐酸的酸性比氢硫酸(H2S水溶液)强,所以非金属性:Cl﹥S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍具有较高的经济价值,工业上采用一定方法处理含镍废水使其达标排放并回收镍。某电镀废水中的镍主要以NiR2络合物形式存在,在水溶液中存在以下平衡:NiR2 (aq) ![]() Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2生成NiS沉淀进而回收镍。
①该反应的离子方程式为_________。
②NiS沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是_________、_________。
(2)“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。工艺流程如下:
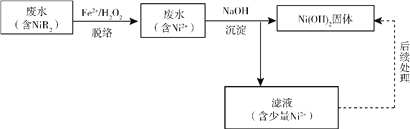
“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R—与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。反应的方程式如下:
Fe2+ + H2O2 ![]() Fe3+ + OH— +·OH …………i
Fe3+ + OH— +·OH …………i
R— + ·OH ![]() OH—+ ·R …………ii
OH—+ ·R …………ii
H2O2 +2·OH ![]() O2↑ + 2H2O …………iii
O2↑ + 2H2O …………iii
实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如右图所示:
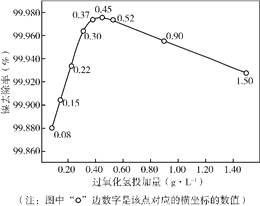
①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是_________。
②分析图中曲线,可推断过氧化氢的最佳加入量为_________ g·L-1;低于或高于这个值,废水处理效果都下降,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的酸性溶液中能大量共存的是( )
A.Na+、K+、Cu2+、SO42-B.NH4+、Na+、NO3-、Cl-
C.K+、Ca2+、HCO3-、Cl-D.Mg2+、Fe3+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )

A.气球B中装的是O2
B.气球A和气球C中气体分子数相等
C.气球A和气球D中气体物质的量之比为4:1
D.气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L乙烷与2.24L苯含C-H键数均为0.6NA
B. 16.8gFe与足量的水蒸气加热充分反应,转移电子数为0.8NA
C. 25C时,1LpH=7的CH3COONH4溶液中含NH4+数一定为1.0×10-7NA
D. 0.2molCO2与0.1molC在密闭容器中充分反应生成CO分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包氯化亚铁样品,其中混有少量的AlCl3、FeCl3等杂质,某小组为了提纯氯化亚铁,进行了如下实验。

(1)步骤ii的目的是____________,其离子方程式为____________。
(2)溶液C中阴离子有____________,反应iii的离子反应方程式为____________。
(3)根据上述实验,下列哪种说法是不合理的_______
①溶液B中含有金属离子只有两种
②溶液C中有两种金属阳离子
③固体D加热可分解
(4)根据样品的质量,判断加入1mol/L NaOH溶液的体积合理的为__________。
① 40mL ② 400mL ③ 4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com