
【题目】甲、乙、丙三种烃分子的结构如图所示,下列有关说法错误的是( )
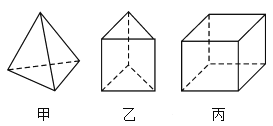
A.1 mol甲分子内含有10 mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.三者不互为同系物
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的某二元弱酸
的某二元弱酸![]() 溶液中逐滴加入NaOH溶液,
溶液中逐滴加入NaOH溶液,![]() A、
A、![]() 、
、![]() 的物质的量分数随pH的变化如图所示。下列叙述正确的是
的物质的量分数随pH的变化如图所示。下列叙述正确的是

A.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
B.![]() 时,溶液中微粒浓度的大小关系为:
时,溶液中微粒浓度的大小关系为:![]()
C.M点时,![]()
![]()
D.已知KHA难溶于水,若用![]() 沉淀
沉淀![]() ,溶液pH在
,溶液pH在![]() 之间为最佳
之间为最佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=﹣1275.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJmol-1
③H2O(g)=H2O(l) △H3=﹣44.0kJmol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)工业上甲醇利用水煤气合成,反应为CO(g)+2H2(g)=CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
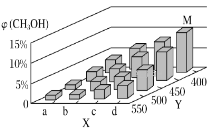
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点___(填“大”或“小”)。
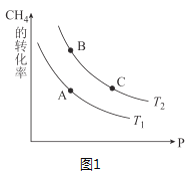
③生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)CO(g)+3H2(g) △H>0,一定条件下CH4的平衡转化率与温度、压强的关系如图1。则T1___T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为____。
(3)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2。
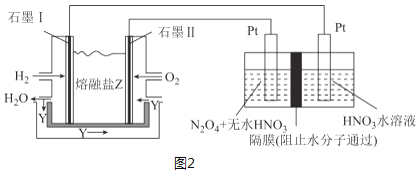
写出石墨Ⅰ电极上发生反应的电极反应式___。在电解池中生成N2O5的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。

下列说法正确的是
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入2 mol SO3(g)
B.保持温度和容器内压强不变,充入2 mol SO2(g)
C.保持温度和容器内压强不变,充入1 mol O2(g)
D.保持温度和容器体积不变,充入1 mol N2 (g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
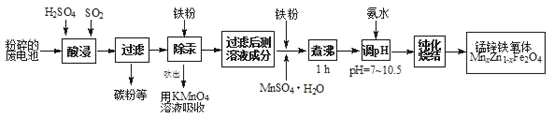
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
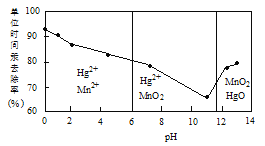
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
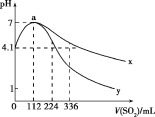
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
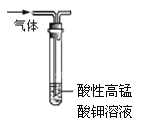
A.用如图装置除去乙烷中混有的乙烯
B.配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏大
C.制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中
D.玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁装入如图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是( )
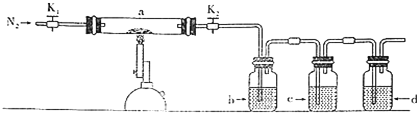
A.装置d之后需要增加尾气处理装置
B.装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成
C.装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D.分解的气体产物中有SO3、SO2,应该先检验SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com