
【题目】在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则其中CO所占的体积为_______,CO2所占的质量为_______,CO2分子数为_______?
【答案】16.8L 11g 0.25NA
【解析】
根据n=![]() 计算混合气体物质的量,根据二者质量、物质的量列方程计算各自物质的量,根据V=nVm计算CO的体积,根据m=nM计算CO2的质量。
计算混合气体物质的量,根据二者质量、物质的量列方程计算各自物质的量,根据V=nVm计算CO的体积,根据m=nM计算CO2的质量。
混合气体物质的量为![]() =1mol,设CO和CO2的物质的量分别为x、y,则:x+y=1mol,28g/mol×x+44 g/mol y=32g,解得x=0.75mol,y=0.25mol,故V(CO)=0.75mol×22.4L/mol=16.8L,m(CO2)=0.25mol×44g/mol=11g,CO2的分子数为0.25mol×NAmol-1=0.25NA,故答案为:16.8L;11g;0.25NA。
=1mol,设CO和CO2的物质的量分别为x、y,则:x+y=1mol,28g/mol×x+44 g/mol y=32g,解得x=0.75mol,y=0.25mol,故V(CO)=0.75mol×22.4L/mol=16.8L,m(CO2)=0.25mol×44g/mol=11g,CO2的分子数为0.25mol×NAmol-1=0.25NA,故答案为:16.8L;11g;0.25NA。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
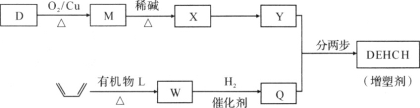
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载,小米“健脾、和胃、安眠”,这主要是某种氨基酸的作用。下列有机物水解能生成氨基酸的是( )
A.蔗糖B.蛋白质C.油脂D.纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关说法正确的是(混合后溶液体积变化忽略不计)
A. 将pH=2的盐酸和pH=5的稀硫酸等体积混合,混合液的pH=3.5
B. 将pH=11的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,混合液的pH=12
C. 将pH=2的H2X溶液稀释至原来的1 000倍,得到混合溶液的pH=5
D. 将pH=1的盐酸和0.1 mol·L-1 的Ba(OH)2溶液等体积混合,混合液的pH=12.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。
(1)写出工业上制备粗硅的化学反应方程式_________________。
(2)SiO2耐腐蚀,但易溶于氢氟酸,写出化学反应方程式: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.测得CO的平衡转化率与压强的关系如图所示。有关说法正确的是

A. 混合气体密度:ρ(x)>ρ(w) B. 正反应速率:v正(w)>v正(y)
C. 反应温度:T2>T3 D. 混合气体的平均摩尔质量:M(y)<M(z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)最大的是________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度最大的是________。
(3)将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是_________。
(4)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,(写出计算式,不必计算最终结果)。温度升高,Ka将______(填“变大”、“不变”或“变小”)。
(5)在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为
A.1.62gB.6.48gC.3.24gD.12.96g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3可采用电解法制备,装置如图所示。下列叙述正确的是

A. 通电后阴极的电极反应式2H2O+2e-=2OH-+H2↑
B. 电解过程中通过阳离子交换膜的离子主要为K+,其迁移方向是从右到左
C. 电解过程中阳极附近pH增大
D. 当电路中通过1mol电子的电量时,会有0.5mol的KIO3生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com