
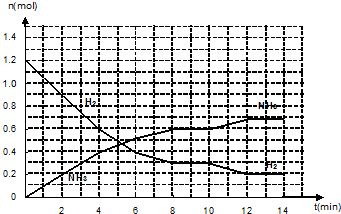
分析 (1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;化学平衡常数只与温度有关;
(2)根据图知,2min时生成n(NH3)=0.2mol,根据方程式知消耗n(N2)=$\frac{1}{2}$ n(NH3)=$\frac{1}{2}$×0.2mol=0.1mol,
v(N2)=$\frac{\frac{△n}{V}}{△t}$;
(3)5min时,反应没有达到平衡状态,反应向正反应方向进行;10~12min间,氢气的物质的量减小、氨气的物质的量增加,平衡正向移动;改变条件的瞬间,氢气和氨气物质的量不变;
(4)压缩容器体积,增大压强平衡向正反应方向移动,氢气的转化率增大,但其多参加反应的物质的量浓度远远小于增加的物质的量浓度.
解答 解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}).{c}^{3}({H}_{2})}$;化学平衡常数只与温度有关,温度不变化学平衡常数不变,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}).{c}^{3}({H}_{2})}$;c;
(2)根据图知,2min时生成n(NH3)=0.2mol,根据方程式知消耗n(N2)=$\frac{1}{2}$ n(NH3)=$\frac{1}{2}$×0.2mol=0.1mol,
v(N2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.1}{10}}{2}$mol/(L.min)=0.005 mol/(L•min),
故答案为:0.005;
(3)5min时,反应没有达到平衡状态,反应向正反应方向进行,则V正大于V逆;10~12min间,氢气的物质的量减小、氨气的物质的量增加,平衡正向移动,则V正大于V逆;改变条件的瞬间,氢气和氨气物质的量不变,只能是增大氮气浓度,
故答案为:大于;大于;C;
(4)压缩容器体积,增大压强平衡向正反应方向移动,氢气的转化率增大,但其多参加反应的物质的量浓度远远小于增加的物质的量浓度,即达到平衡时c(H2)大于0.03mol/L,
故答案为:向右;大于.
点评 本题考查化学平衡计算及外界条件对化学反应平衡影响,为高频考点,侧重考查学生图象分析判断能力,难点是(4)题分析,很多同学往往认为平衡正向移动,则平衡时氢气浓度小于0.03mol/L而导致错误,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向5mL 0.4mol•L-1 NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | |
| B. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖 | |
| C. | 用某已知浓度的HCl 滴定未知浓度的NaOH,滴定前尖嘴有气泡滴定终点气泡消失,则测定所得NaOH的浓度偏低 | |
| D. | 向氯水中滴加AgNO3、稀HNO3溶液,若产生白色沉淀,则说明氯水中含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | |||||||||
| B. | 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量浓的AgNO3溶液,则最先析出AgBr沉淀并且其沉淀量多于AgCl沉淀 | |||||||||
| C. | 反应A(g)?2B(g)△H若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=Ea-Eb kJ•mol-1 | |||||||||
| D. | 已知:
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com