
【题目】已知1,3—丁二烯(CH2=CH—CH=CH2)与溴水发生1: 1加成(物质的量之比)时,加成产物有如下2种:CH2=CH—CH=CH2+Br2![]() CH2BrCHBr-CH=CH2 (称为1,2-加成);CH2=CH—CH=CH2+Br2
CH2BrCHBr-CH=CH2 (称为1,2-加成);CH2=CH—CH=CH2+Br2![]() CH2BrCH=CHCH2Br (称为1,4-加成)。
CH2BrCH=CHCH2Br (称为1,4-加成)。
现有C4H4有多种同分异构体,它们分别具有以下特征,试写出相应同分异构体的结构简式:
(1)A为链状结构,可由两分子乙炔加成得到,A的结构简式为________________;
(2)B为平面结构,与Br2发生1:1(物质的量之比),加成方式有2种,但加成产物只有1种,B的结构简式为___________________________________________;
(3)C为正四面体结构,每个碳原子与另外3个碳通过单键相连,C的的结构简式为_______________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂化学计量数为1:2的是( )
A.Fe+2HCl═FeCl2+H2↑
B.2HCl+Ca(ClO)2═2HClO+CaCl2
C.I2+2NaClO3═2NaIO3+Cl2↑
D.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Ca2+、Ba2+、CO32﹣、SO42﹣,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g.
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl﹣_____,
(2)由第二份进行的实验可知混合物中应含_____离子,其物质的量浓度为_____.
(3)由第三份进行的实验可知12.54g 沉淀的成份为_____.请计算形成该沉淀的原混合物中各离子的物质的量_____.
(4)综合上述实验,你认为以下结论正确的是_____
A.该混合物中一定含有K+、NH4+、CO32﹣、SO42﹣,可能含有Cl﹣,且n(K+)≥0.04mol
B.该混合物中一定含有NH4+、CO32﹣、SO42﹣,可能含有Ca2+、K+、Cl﹣
C.该混合物中一定含有NH4+、CO32﹣、SO42﹣,可能含有K+、Cl﹣
D.该混合物中一定含有NH4+、SO42﹣,可能含有Ca2+、K+、Cl﹣.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示.
(1)物质X:CH3CH=CHCH3可表示为![]()
X可以与溴水反应,该反应的化学方程式是_________________________;
X可以发生加聚反应,其产物分子的结构简式是______________________.
(2)一种有机物Y的键线式如图所示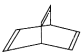
①Y的分子式为___________;
②有机物Z是Y的同分异构体,且属于芳香族化合物,则Z的结构简式是______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
(1)该电池反应的总离子方程式为____________________________________________。
(2)甲醇在______极发生反应(填正或负),电池在放电过程中溶液的pH将______(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2________升。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的负极反应式为____________________________________________。
②放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项决定于原子结构的哪一部分:①质子数,②中子数,③原子的最外层电子数。(以下各项选择序号填空)
(1)元素的种类取决于____________;
(2)原子的质量数主要由______________决定;
(3)元素的化学性质主要由____________决定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A﹣,回答下列问题:
H++A﹣,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向______(填“正”、“逆”)反应方向移动。
(2)若向溶液中加水稀释,以上平衡将向_______(填“正”、“逆”)反应方向移动,溶液中c(A﹣)将____(填“增大”、“减小”或“不变”),溶液中c(OH﹣)将____(填“增大”、“减小”或“不变”)。
(3)已知室温时,0.1mol·L﹣1的某一元酸HA在水中有 0.1% 发生电离,回答下列各问题:
①该溶液的pH=_______。
②HA的电离平衡常数K=________。
③NaA溶液显碱性的原因:_____________________________(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com