
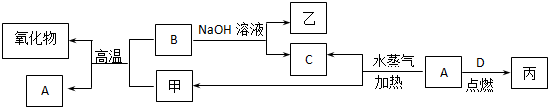
分析 A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体,D为Cl2,甲具有磁性的物质,则甲为Fe3O4,甲与B的反应为铝热反应,B为Al,A为Fe,乙为NaAlO2,C为H2,Fe与氯气反应生成丙,丙为FeCl3,然后结合元素化合物性质及离子检验来解答.
解答 解:A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体,D为Cl2,甲具有磁性的物质,则甲为Fe3O4,甲与B的反应为铝热反应,B为Al,A为Fe,乙为NaAlO2,C为H2,Fe与氯气反应生成丙,丙为FeCl3,
(1)B与甲反应的化学方程式是8A1+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4A12O3+9Fe,与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式为2A1+2OH-+2H2O═2A1O2+3H2↑,甲与足量盐酸溶液反应的离子方程式是:Fe3O4+8H+=Fe3++2 Fe2++4H2O,
故答案为:8A1+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4A12O3+9Fe;2A1+2OH-+2H2O═2A1O2+3H2↑;Fe3O4+8H+=Fe3++2 Fe2++4H2O;
(2)含有B形成的阳离子的溶液含有A13+,可与A1O2-发生互促水解反应生成氢氧化铝沉淀,反应的离子方程式为A13++3A1O2-+6H2O═4A1(OH)3↓,
故答案为:A13++3A1O2-+6H2O═4A1(OH)3↓;
(3)丙溶液中所含金属阳离子为Fe3+,可用KSCN溶液鉴别,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+,
故答案为:取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+.
点评 本题综合考查无机物的推断、电解等知识,注意利用物质的性质及转化关系推断物质为解答的关键,侧重分析能力、推断能力及知识综合应用能力的考查,答题时注意把握物质的颜色以及磁性等信息,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组为了探究甲烷和氯气反应的情况,设计了如下实验.请填写下列空白:
某研究小组为了探究甲烷和氯气反应的情况,设计了如下实验.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量的溴水 | B. | 通入足量的酸性高锰酸钾溶液 | ||
| C. | 在导管口点燃 | D. | 一定条件下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 酚酞呈红色的溶液:NH4+、Ba2+、CO32-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯气和氢氧化钠溶液制消毒水 | B. | 用铝热法冶炼金属钒 | ||
| C. | 用油脂制肥皂 | D. | 海水提溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测量溶液的温度计要一直插在溶液中 | |
| B. | 应该向酸(碱)中慢慢滴加碱(酸) | |
| C. | 反应前需要用温度计测量酸(碱)温度 | |
| D. | 反应中酸或碱应适当过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com