
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 除去淀粉中NaCl杂质,可将混合物加水溶解后,用渗析的方法分离 |
分析 A.分液时应避免液体重新混合而污染;
B.蒸馏时,温度计用于测量馏分的温度;
C.酒精与水混溶;
D.淀粉不能透过半透膜.
解答 解:A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可避免液体重新混合而污染,故A正确;
B.蒸馏时,温度计水银球靠近蒸馏烧瓶支管口,用于测量馏分的温度,故B正确;
C.萃取剂不能溶于水,酒精与水混溶,不能用作萃取剂,故C错误;
D.淀粉不能透过半透膜,可用渗析的方法分离,故D正确.
故选C.
点评 本题考查了萃取、分液、过滤、蒸馏等基本实验操作,过滤适用于不溶性的固体和液体的分离,萃取是利用溶质在互不相溶的溶剂里溶解度不同的分离,蒸馏适用于沸点相差较大的液体混合物的分离,萃取、分液、蒸馏、过滤是物质分离、提纯的常用物理方法.要注意分馏和馏分的区别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
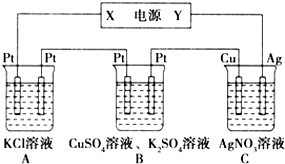 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里. | |
| B. | 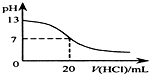 如图表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 | |
| D. | 常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子反应方程式 | |
| ①Fe(Al) | ||
| ②FeCl 2溶液(FeCl3) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com