
| A. | 将电石与水反应产生的气体先通入CuSO4溶液再通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3或K2SO3 | |
| C. | 将浓硫酸和乙醇溶液共热产生的气体干燥后通入溴的四氯化碳溶液,溶液褪色,说明有乙烯生成 | |
| D. | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,不能说明有HBr生成 |
分析 A.硫酸铜溶液除去了乙烯中的硫化氢,若酸性高锰酸钾溶液褪色,证明生成的乙炔;
B.生成的气体可能为二氧化碳或二氧化硫,该钾盐可能为碳酸氢钾或亚硫酸氢钾;
C.溴的四氯化碳溶液褪色,可以证明有乙烯生成;
D.液溴易挥发,挥发出来的溴能够与硝酸银溶液反应生成溴化银沉淀.
解答 解:A.将电石与水反应产生的气体中含有硫化氢,先通入CuSO4溶液除去杂质硫化氢,排除了干扰,再通入酸性KMnO4溶液中,溶液褪色能够说明有乙炔生成,故A正确;
B.某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,该气体可能为二氧化碳或二氧化硫,该钾盐可能为KCO3或KHSO3,不一定为K2CO3或K2SO3,故B错误;
C.将浓硫酸和乙醇溶液共热产生的气体干燥后通入溴的四氯化碳溶液,溶液褪色,能够证明反应中有乙烯生成,故C正确;
D.液溴易挥发,产生的气体中含有溴单质,溴单质能够与到AgNO3溶液反应生成淡黄色沉淀,则不能说明有HBr生成,故D正确;
故选B
点评 本题考查了化学实验方案的评价,题目难度不大,涉及物质检验与鉴别、常见有机物结构与性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | SO2能使FeCl3、酸性KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 氨气和酸相遇都能产生白色烟雾 | |
| D. | 在反应NH3++H+=NH4+中,氨失去电子被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
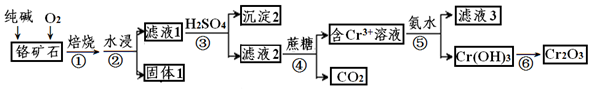
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
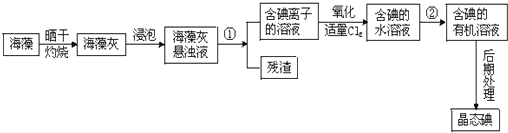
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据Ksp(AgCl)>Ksp( AgBr),可知AgCl的溶解能力比AgBr强 | |
| B. | 加入足量浓AgNO3溶液后,AgCl和AgBr的溶度积Ksp均不变 | |
| C. | 加入足量浓AgNO3溶液后,溶液中只有AgBr沉淀 | |
| D. | 在含有AgBr、AgCl固体的悬浊液中,c (Cl-)>c (Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
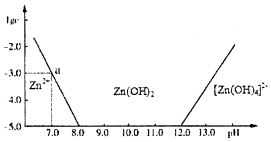 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
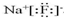 ,
, O2-
O2-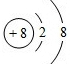 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
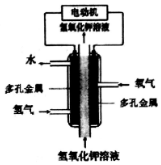
| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com