
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱反应放出热量。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置进行实验。
5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是________。
②该兴趣小组用100 mL12 mol·L-1盐酸与8.7 g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高也是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。

①图中曲线Ⅰ表示_______离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.35 mol,则产物中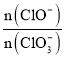 =__。
=__。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你写出一种改进方法:________。
【答案】除去氯气中的氯化氢气体 7.15 ClO- 0.25 2:1 把丙装置浸在盛有冰水的水槽中
【解析】
(1)①饱和食盐水的主要作用是除去氯气中的氯化氢气体;
②依据MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值;
MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值;
(2)①当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,根据温度高低来判断属于哪种离子;
②根据氧化还原反应中得失电子数相等计算氯离子的物质的量,然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量;
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.35 mol,依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,结合b计算得到氢氧化钙物质的量计算氯元素物质的量,依据氧化还原反应电子守恒,生成产物中氯元素守恒列式计算。
(3)根据题中信息,在高温度下发生副反应,可以把丙装置放入冰水中。
(1)①浓盐酸和二氧化锰反应制取氯气的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,在反应制取氯气的过程中挥发出HCl气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;
MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,在反应制取氯气的过程中挥发出HCl气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;
②n(HCl)=12 mol/L×0.1 L=1.2 mol,n(MnO2)= ![]() =0.1 mol,MnO2、HCl反应的物质的量的比是1:4,可见足量的浓盐酸与8.7 gMnO2制备氯气,以MnO2为标准计算,n(Cl2)=n(MnO2)=0.1 mol,将所得氯气与过量的石灰乳反应,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据方程式中物质反应关系可知:理论上最多可制得Ca(ClO)2的物质的量为0.05 mol,其质量m[Ca(ClO)2]=0.05mol×143 g/mol=7.15 g;
=0.1 mol,MnO2、HCl反应的物质的量的比是1:4,可见足量的浓盐酸与8.7 gMnO2制备氯气,以MnO2为标准计算,n(Cl2)=n(MnO2)=0.1 mol,将所得氯气与过量的石灰乳反应,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据方程式中物质反应关系可知:理论上最多可制得Ca(ClO)2的物质的量为0.05 mol,其质量m[Ca(ClO)2]=0.05mol×143 g/mol=7.15 g;
(2)①当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
②根据氧化还原反应中得失电子数相等计算Cl-的物质的量,设被还原的氯离子的物质的量为n,则n×1=0.10 mol×1+0.05 mol×5=0.35 mol,则反应的Cl2中含氯原子的物质的量为:0.35 mol+0.1 mol+0.05 mol=0.5 mol,在CaCl2、Ca(ClO)2、Ca(ClO3)2中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为![]() =0.25 mol;
=0.25 mol;
③取一份与②等物质的量的石灰乳,其物质的量为0.25 mol,根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO-)=x,n(ClO3-)=y;则得到:0.35=x×1+y×5;依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,得到氯元素物质的量为0.5mol;x+y+0.35=0.5,解得:x=0.1 mol,y=0.05 mol,则产物中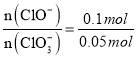 =2:1;
=2:1;
(3)由于反应在高温度下发生副反应,所以改进措施可以把丙装置放入盛有冰水的水槽中,避免发生3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。
5Cl-+ClO3-+3H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色
B. 向氯乙烷中加入硝酸银溶液,可以鉴定其中的氯原子
C. 将等体积的苯、汽油和水在试管中充分振荡后静置,现象如图所示:
![]()
D. 可用灼烧的方法鉴别蛋白质和纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有淀粉的 KIO3 酸性溶液滴加 NaHSO3 溶液,溶液先变蓝后褪色。下列说法错误的是
A.溶液先变蓝的原因:2IO![]() +5HSO
+5HSO![]() =I2+5SO
=I2+5SO![]() +H2O+3H+
+H2O+3H+
B.溶液恰好褪色时 n(KIO3):n(NaHSO3)=1:3
C.还原性 I-> HSO![]() >I2
>I2
D.若向含有淀粉的 NaHSO3 溶液中滴加过量 KIO3 酸性溶液,则溶液变蓝不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )


甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期主族元素 X、 Y、 Z、 R、 Q, 它们的原子序数逐渐增大; 在周期表中的相对位置如图所示,Z是组成叶绿素的金属元素。下列说法错误的是
![]()
A.工业上都用电解法制Z、R单质
B.X和Y 的单质熔点: X<Y
C.Z、R、Y 的简单离子半径: Y>Z>R
D.Y和Q的最高价氧化物对应水化物酸性:Y>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g)==C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是 ( )
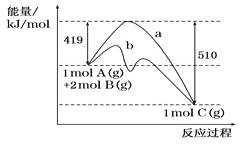
A. 正反应活化能大于逆反应活化能
B. 曲线b表示使用催化剂后的能量变化
C. 由图可知该反应的焓变△H=+91kJ/mol
D. 反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com