
| A. | 向NaOH溶液中通入氯气:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 氨气与盐酸反应:NH3+HCl═NH4++Cl- | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
分析 A.氢氧化钠溶液与氯气反应生成氯化钠、次氯酸钠和水;
B.HCl为强电解质,离子方程式中应该拆开;
C.醋酸为弱酸,离子方程式中应该保留分子式;
D.稀硝酸为氧化性酸,铁与稀硝酸反应生成NO气体,不会生成氢气.
解答 解:A.向NaOH溶液中通入氯气,反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O,故A正确;
B.氨气与盐酸反应生成氯化铵,正确的离子方程式为:NH3+H+═NH4+,故B错误;
C.碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.铁与稀硝酸反应生成NO气体,若铁片过量,反应生成硝酸亚铁,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故D错误;
故选A.
点评 本题考查了离子方程式的书写,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握常见的需要保留化学式的物质,如难溶物、弱电解质、氧化物等,D为易错点,注意铁与稀硝酸反应不会生成氢气.


科目:高中化学 来源: 题型:解答题
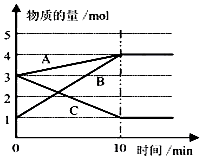 化学反应速率与限度与生产、生活密切相关
化学反应速率与限度与生产、生活密切相关| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸溶液导电性比乙酸溶液导电性强,说明乙酸是弱酸 | |
| B. | 硫酸钾溶于水能导电,所以硫酸钾是电解质 | |
| C. | 强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 | |
| D. | 固态磷酸是电解质,所以磷酸在熔融状态下和水溶液中都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、纯碱 | |
| C. | 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O2、CaO、MgO、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2的浓度之比保持不变 | |
| B. | N2和H2的反应速率之比为1:3 | |
| C. | NH3的生成速率与H2的生成速率之比为2:3 | |
| D. | 体系中N2、H2、NH3的分子个数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
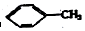 ②
②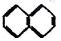 ③
③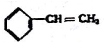 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦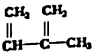 ⑧
⑧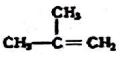
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | 非金属性:Cl>C>Si |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 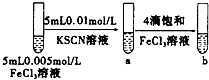 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com