
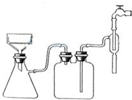
 茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)| 1 |
| 2 |
| 500mL |
| 20mL |
| 7.95g |
| 106g/mol |
| 2g |
| 500g |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
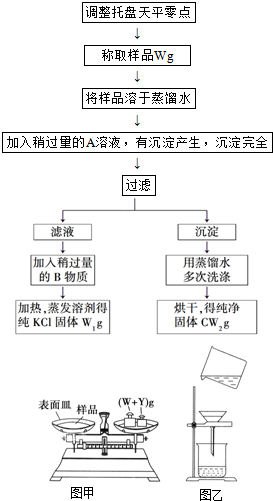 实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.
实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中, | 含有Cl- | |
| 2.检验NH4+ | 取少许滤液于试管中, | 含有NH4+ | |
| 3.检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol?L-1 |
| B、0.3mol?L-1 |
| C、0.42mol?L-1 |
| D、无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com