
| A. | NaOH | B. | H2O | C. | MgCl2 | D. | Na2O2 |
分析 活泼金属元素和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,铵根离子和酸根离子之间存在离子键.
解答 解:A.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故A正确;
B.水分子中H-O原子之间只存在极性键,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,故C错误;
D.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故D错误;
故选A.
点评 本题考查化学键判断,为高频考点,侧重考查基本概念,明确物质构成微粒及微粒之间作用力是解本题关键,注意离子键和共价键的区别,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
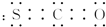 ,其分子呈直线形.
,其分子呈直线形. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
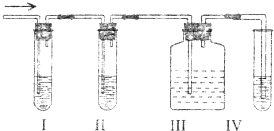 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度相等 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层序数越大,s原子轨道的形状相同,半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态 | |
| D. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学研究会造成严重的环境污染,最终人类会毁灭在化学物质中 | |
| B. | 化学研究的主要目的是认识分子 | |
| C. | 化学家可以制造出自然界中不存在的物质 | |
| D. | 俄国化学家门捷列夫提出了原子学说,为近代化学的发展奠定了基础 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径:C>D>A>B | B. | 核电核数:b>a>d>c | ||
| C. | 原子半径:A>B>D>C | D. | 元素的电负性:A>B>C>D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com