
| A、32gO2和O3的混合气体中含有的氧原子数为2NA |
| B、标况下,11.2L乙醇中所含的碳原子数目为NA |
| C、1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 NA |
| D、过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |
| 32g |
| 16g/mol |


科目:高中化学 来源: 题型:

| 物质 | 熔点/℃ | 沸点/℃ |
| CH3CH2Br | -119 | 38 |
| BrCH2CH2Br | 9 | 131 |
| CH3CH2OH | -114 | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL 1mol/L氯化钠溶液 |
| B、75mL 2mol/L 氯化铵溶液 |
| C、150mL 1mol/L氯化钾溶液 |
| D、75mL 3mol/L氯化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 甲醇中含有C-H键的数目为4NA |
| B、0.1mol 丙烯酸中含有双键的数目为0.1NA |
| C、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
| D、常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的最简式:C2H4 |
| B、CS2分子的结构式:S═C═S |
| C、醛基的结构简式:-CHO |
D、-OH(羟基)的电子式为: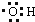 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com