
| 100g×0.0012mol |
| 2mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
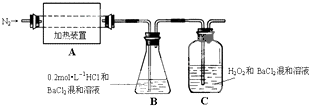 硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
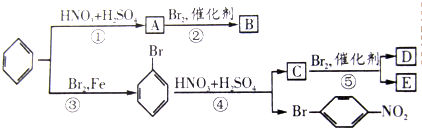
科目:高中化学 来源: 题型:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | 不含有Li、Na等活泼金属 |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 |
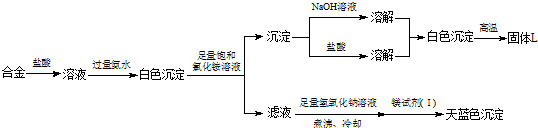
 问题讨论:
问题讨论:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热,观察是否有气体放出 |
| B、溶于水后加石灰水,看有无沉淀 |
| C、溶于水后加MgCl2溶液,看有无沉淀 |
| D、加热后称量,看质量是否变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、蔗糖和麦芽糖的水解产物都是葡萄糖 |
| C、石油经过分馏得到的各种产物是不同温度范围内的混合物 |
| D、苯和苯乙烯的最简式相同,是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
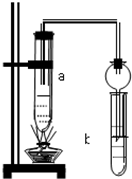 如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.
如图所示,在试管a中先加2mL乙醇,边摇动边缓缓加入5mL浓硫酸,摇匀冷却后,再加入2g无水醋酸钠,充分搅动后,固定在铁架台上.在试管b中加入适量的饱和Na2CO3溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①?? |
| B、只有①②?? |
| C、只有①②③?? |
| D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com