
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可组成化合物E3B2,且该物质遇水发生水解反应。已知利用如下图所示装置以制备E3B2,装置①用于制备B单质。

下列说法正确的是
A. E与B的简单离子的电子层结构相同,且简单离子半径B<E
B. ④⑥中依次盛装的试剂可以是NaOH溶液、碱石灰
C. D元素形成的单质与A2C不反应
D. 实验结束后,取⑤中的少量产物于试管中,加适量蒸馏水,可以产生使试管口湿润的红色石蕊试纸变蓝的气体
【答案】D
【解析】
短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,则A为H元素,B为N元素;A和D同主族,则D为Na元素;B和C相邻,C为O元素;F的最高价氧化物对应的水化物为无机含氧酸中的最强酸,则F为Cl元素。E与B可组成化合物E3B2,且该物质遇水发生水解反应,E为+2价金属,为Mg元素;根据装置图,在装置⑤中制备Mg3N2,装置①用于制备N2,装置②为安全瓶,③④用于除去氮气中的杂质并干燥,装置⑥防止空气中的水蒸气进入装置⑤,据此答题。
A.电子层结构相同的离子,核电荷数越大,离子半径越小,Mg与N的简单离子的电子层结构相同,离子半径B>E,故A错误;
B.饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气,NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,氮气中的杂质主要是空气中的氧气,氧气能够与镁反应,需要除去,用NaOH溶液不能除去,故B错误;
NaCl+N2↑+2H2O,氮气中的杂质主要是空气中的氧气,氧气能够与镁反应,需要除去,用NaOH溶液不能除去,故B错误;
C.钠与水反应生成氢氧化钠和氢气,故C错误;
D.Mg3N2+6H2O=2NH3↑+3Mg(OH)2,氨气的水溶液显碱性,可以使试管口湿润的红色石蕊试纸变蓝,故D正确。
故D正确。


科目:高中化学 来源: 题型:
【题目】(1)丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入________(“+”或“-”)。写出表示丙烷燃烧热的热化学方程式:__________________。

(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答问题:
已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.两种难溶盐电解质,其中Ksp小的溶解度一定小
B.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀
C.难溶盐电解质的Ksp与温度有关
D.同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2+(蓝色)+H2O+V3+(绿色) ![]() VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
A. 充电时,反应每生成2 mol H+时转移的电子的物质的量为1 mol
B. 充电时,阳极附近溶液由绿色逐渐变为紫色
C. 放电时,负极反应为V2+-e-===V3+
D. 放电过程中,正极附近溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是
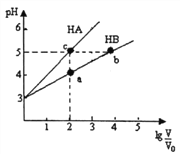
A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3②NO2进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( )

A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子的最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且元素Y的基态原子核外电子p电子比s电子多5个。
(1)Z的基态原子的核外电子排布式为_____________。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯()裂化生成苯和丙烯。
①1 mol丙烯分子中含有σ键与π键数目之比为_____________。
②苯分子中碳原子的杂化轨道类型为_____________。
③Z的一种氧化物ZO5中,Z的化合价为+6价,则其中过氧键的数目为_________个。

(3)W、X、Y三种元素的电负性由小到大的顺序为_______(请用元素符号回答)。
(4)ZY3的熔点为1 152 ℃,其在熔融状态下能够导电,据此可判断ZY3晶体属于_________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图所示,每个Z原子周围最近的X原子数目为________。若该化合物的相对分子质量为M,晶胞边长为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60mL B. 90mL C. 120mL D. 45mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com