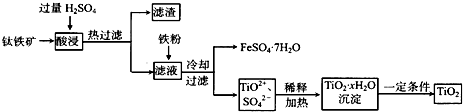
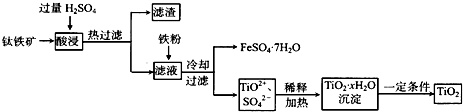
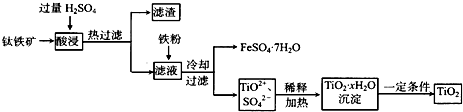
(2011?宣城二模)镁及其化合物在生产生活中有重要的作用.以水氯镁石(主要成分为MgCl
2?6H
2O)为原料生产碱式碳酸镁的主要流程如下:
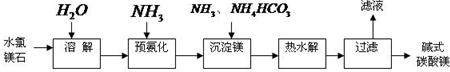
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为
NH4Cl
NH4Cl
.指出该物质在工农业生产中的一种用途:
做氮肥(或其他合理答案)
做氮肥(或其他合理答案)
.
(2)写出预氨化时发生的主要反应的离子方程式:
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
.
(3)沉淀镁时反应的温度不宜过高,原因是
防止碳酸氢铵分解
防止碳酸氢铵分解
.
(4)设计一个实验,确定产品碱式碳酸镁aMgCO
3?bMg(OH)
2?cH
2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③
测出CO2的质量
测出CO2的质量
;④
测出水蒸气的质量
测出水蒸气的质量
;⑤称量MgO.18.2g产品完全分解后,产生6.6g CO
2和8.0g MgO,由此可知,产品的化学式中:a=
3
3
;b=
1
1
;c=
3
3
.
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是
不同意
不同意
.理由是
因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
.