
��˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H= - 24.8kJ��mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) ��H= - 47.2kJ��mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ��H= +640.5kJ��mol
д��CO���廹ԭFeO����õ�Fe �����CO2������Ȼ�ѧ��Ӧ����ʽ��
CO��g��+FeO��s��=Fe��s��+CO2��g����H=-218.0kJ/mol
��������������ɢ١�3-��-�ۡ�2�� 6CO��g��+6FeO��s��=6Fe��s��+6CO2��g�� ��H=��-24.8kJ/mol����3-��-47.2kJ/mol��-��+640.5kJ/mol����2=-1308.0kJ/mol���� CO��g��+FeO��s��=Fe��s��+CO2��g����H="-218.0kJ/mol"
�ʴ�Ϊ��CO��g��+FeO��s��=Fe��s��+CO2��g����H=-218.0kJ/mol
���㣺���⿼������ø�˹���ɼ��㷴Ӧ�ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��P4(g)+6Cl2(g)��4PCl3(g) ��H��a kJ?mol��1��P4(g)+10Cl2(g)��4PCl5(g) ��H��b kJ?mol��1
P4������������ṹ��PCl5��P��Cl���ļ���Ϊc kJ?mol��1��PCl3��P��Cl���ļ���Ϊ1��2c kJ?mol��1������������ȷ����
| A��P��P���ļ��ܴ���P��Cl���ļ��� |
| B������Cl2(g)+ PCl3(g)��4PCl5(s)�ķ�Ӧ�ȡ�H |
| C��Cl��Cl���ļ���Ϊ(b��a+5��6c)/4 kJ?mol��1 |
| D��P��P���ļ���Ϊ(5a��3b+12c)/8 kJ?mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������Դ��﮵��صĵ�ط�ӦΪ��2 Li(s) + I2 (s) =" 2" LiI(s) ��H
��֪��4 Li(s) + O2 (g) =" 2" Li2O(s) ��H1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ��H2 ������˵����ȷ����( )
| A����H=1/2��H1 -��H2 | B����H=1/2��H1 +��H2 |
| C����H=1/2��H1 -1/2��H2 | D����H=1/2��H1 +1/2��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Ӧ A+B ��C����H ��0������������ �� A+B��X ����H ��0�� �� X��C����H ��0������ʾ��ͼ�У�����ȷ��ʾ�ܷ�Ӧ�����������仯���ǣ� ��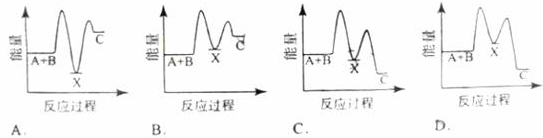
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����Zn(s)��H2SO4(aq)=ZnSO4(aq)��H2(g)����H=���Ļ�ѧ��Ӧ��������������ȷ����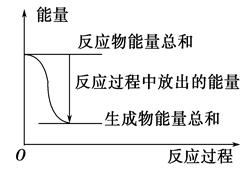
| A����Ӧ������������ϵ����ͼ��ʾ����÷�ӦΪ���ȷ�Ӧ |
| B�����������Ϊԭ��أ�����32.5 gп�ܽ�ʱ�������ų�����һ��Ϊ11.2 L |
| C����ѧ��Ӧ���ʱ��뷴Ӧ����ʽ�ļ���ϵ���й� |
| D�������÷�Ӧ��Ƴ�ԭ��أ�пΪ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
SF6��һ�������ľ�Ե���壬���ӽṹ��ֻ����S��F������֪��1 mol S(s)ת��Ϊ��̬��ԭ����������280 kJ������1 mol F��F��S��F�������յ������ֱ�Ϊ160 kJ��330 kJ����S(s)��3F2(g)=SF6(g)�ķ�Ӧ�Ȧ�HΪ(����)
| A����1 780 kJ��mol��1 | B����1 220 kJ��mol��1 |
| C����450 kJ��mol��1 | D����430 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ͼ��ʾͼ��д����Ӧ���Ȼ�ѧ����ʽ���ش��������⣺

��1����Ӧ���̢ٵ��Ȼ�ѧ����ʽΪ��____________________________________________��
��2����Ӧ���̢ڵ��Ȼ�ѧ����ʽΪ��____________________________________________��
��3��Q2��Q1�Ĺ�ϵ��Q2________Q1(����ڡ���С�ڡ����ڡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+(aq)+OH-(aq)=H2O��1�� ��H=��57��3kJ��mol����1L0��5mol��L��NaOH��Һ�м����������ʣ���ϡ���� ��Ũ���� ��ϡ���ᣬǡ����ȫ��Ӧʱ����ЧӦ��H1����H2����H3�Ĺ�ϵ��ȷ����
| A����H1>��H2>��H3 | B����H1<��H3<��H2 |
| C����H1<��H2<��H3 | D����H1>��H3>��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ӦCO(g)��2H2(g)  CH3OH(g)�����е������仯�������ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ����
CH3OH(g)�����е������仯�������ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ����
| A���÷�Ӧ�Ħ�H����91 kJ/mol |
| B����������������淴Ӧ�Ļ����ֵ����С |
| C������������÷�Ӧ�Ħ�H��С |
| D������÷�Ӧ����Һ̬CH3OH����H��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com