
| A. | 温度130℃、压强3.03×105Pa | B. | 温度25℃、压强1.01×105Pa | ||
| C. | 温度130℃、压强5.05×105Pa | D. | 温度0℃、压强5.05×105Pa |
科目:高中化学 来源: 题型:解答题
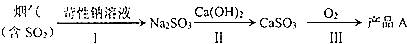
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容容器中发生反应C(s)+H2O(g)?CO(g)+H2(g),当混合气体密度不变时反应达到平衡 | |
| B. | 平衡向右移动时,反应物的转化率一定增大,平衡常数不一定增大 | |
| C. | 恒温时向BaSO4悬浊液中加入Na2SO4固体,Ba2+浓度减小,溶度积KsP (BaSO4)不变 | |
| D. | 向氨水中逐滴加入盐酸,溶液呈中性时离子浓度为:c(Cl-)═c(NH4+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
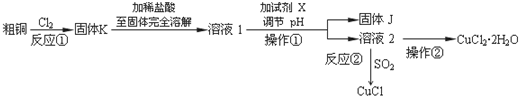
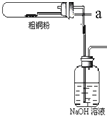
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将28.6 g Na2CO3•10H2O溶于100 mL蒸馏水中,可以配成100 mL 1.0 mol/L Na2CO3溶液 | |
| B. | 可以用重结晶法除去KNO3固体中混杂的NaCl,这是因为NaCl在水中的溶解度很大 | |
| C. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏小 | |
| D. | 金属Mg与CO2和稀硫酸均能反应,其反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
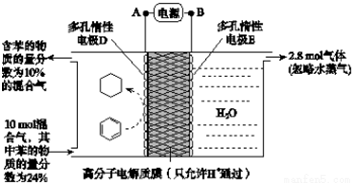 BCl3是重要的化工原料,其沸点12℃.500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s)+3C(s)+3Cl2(g)?2BCl3 (g)+3CO(g).
BCl3是重要的化工原料,其沸点12℃.500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s)+3C(s)+3Cl2(g)?2BCl3 (g)+3CO(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 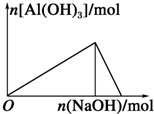 向AlCl3溶液中滴加NaOH溶液 | B. |  向NaOH溶液中滴加AlCl3溶液 | ||
| C. | 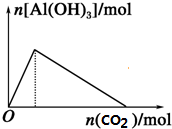 向NaAlO2溶液中滴加CO2 | D. |  向AlCl3溶液中滴氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com