
| A. | 用食醋除去热水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Cl2溶于水:Cl2+H2O═H++Cl-+HClO | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
分析 A.水垢的主要成分为CaCO3,离子方程式中碳酸钙不可拆开;
B.根据董事会判断,离子方程式两边负电荷不相等;
C.氯气与水反应生成氯化氢和次氯酸,次氯酸为弱酸,需要保留分子式;
D.溶液为中性,则氢离子与氢氧根离子完全反应,离子方程式按照氢氧化钡的化学式组成书写.
解答 解:A.水垢的主要成分碳酸钙为难溶物,不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故B错误;
C.Cl2溶于水生成氯化氢和次氯酸,反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故C正确;
D.NaHSO4溶液与Ba(OH)2溶液反应至中性,氢离子和氢氧根离子都恰好反应,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
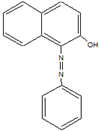 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )| A. | 它属于芳香烃 | B. | 它的分子式为C16H13ON2 | ||
| C. | 它能发生取代反应和加成反应 | D. | 它与苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +43.5 | B. | -43.5 | ||
| C. | -67.7 | D. | +67.7(单位:kJ•mol-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热 46.3 kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
| A. | 达平衡时,两个容器中NH3的物质的量浓度相等 | |
| B. | 容器①中反应从开始到刚达平衡时用NH3表示的反应速率为v(NH3)=$\frac{1}{30}$mol•L-1•s-1 | |
| C. | 若容器①体积为0.3 L,则达平衡时放出的热量大于46.3kJ | |
| D. | 容器②中反应达到平衡时吸收的热量为Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滴定管装标准液时应先水洗后用标准液润洗再装入标准液 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 萃取实验中振荡分液漏斗时,应关闭其玻璃塞并打开活塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用 | |
| B. | 含乙醇、NaClO、H2O2等消毒液均可以将病毒氧化而达到消毒目的 | |
| C. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 | |
| D. | 碳酸铝是一种应用很广的食品添加剂,可大量添加到馒头、面包等食品中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com