
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | ${K_{a_1}}$=1.54×10-2 |
| ${K_{a_2}}$=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 1mol•L-1NaHA溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH变大 | |
| D. | 已知某温度下常见弱酸的电离平衡常数如表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 |
分析 A、NaHA可能为强酸的酸式盐,溶液中可能不存在H2A;
B、根据电荷守恒c(Na+)+c(H+)>c(OH-)+c(CH3COO-),溶液为酸性,故氢离子浓度大于氢氧根离子浓度,故c(Na+)<c(CH3COO;
C、缓冲体系中溶液pH值保持恒定;
D、相同温度下,酸的强弱酸性是:H2SO3>HF>CH3COOH>HSO3-,酸根离子水解程度大小顺序是:HSO3-<F-<CH3COO-<SO32-.
解答 解:A、NaHA可能为强酸的酸式盐,溶液中可能不存在H2A,故A错误;
B、根据电荷守恒c(Na+)+c(H+)>c(OH-)+c(CH3COO-),溶液为酸性,故氢离子浓度大于氢氧根离子浓度,故c(Na+)<c(CH3COO-),故B错误;
C、缓冲体系中溶液pH值保持恒定,故C错误;
D、相同温度下,酸的强弱酸性是:H2SO3>HF>CH3COOH>HSO3-,酸根离子水解程度大小顺序是:HSO3-<F-<CH3COO-<SO32-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的离子总数相应变大,所以相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3,故D正确.
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的分析判断,溶液中离子的特征性质和水解、电离,是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol•L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
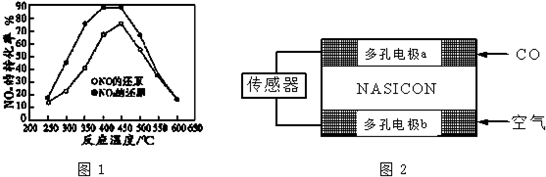
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 | |
| B. | 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理 | |
| C. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
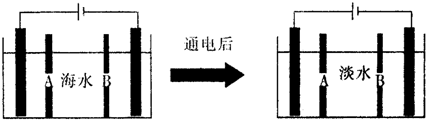
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
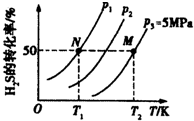 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
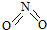 和
和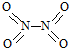 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
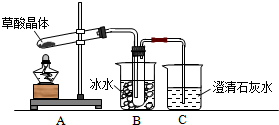
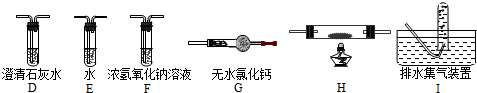
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
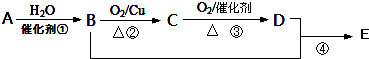
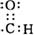 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com