
| 选项 | 实验 | 现象 | 结论 |
| A | 漂白粉在空气中久置 | 漂白粉变为块状 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 用坩埚钳夹住点燃的镁条伸入二氧化碳气体中 | 镁条剧烈燃烧 | 二氧化碳作还原剂 |
| C | 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 |
| D | 向浓度均为0.1mol•L-1的Al2(SO4)3、Fe2(SO4)3的溶液中逐滴加入氨水 | 先有红褐色沉淀生成,后有白色色沉淀生成 | Al(OH)3的溶度积比Fe(OH)3的大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.漂白粉中的CaCl2不与空气中的CO2反应;
B.燃烧反应中Mg被氧化,二氧化碳做氧化剂;
C.甲基橙的变色范围为3.1~4.4,无法证明碳酸氢钠呈碱性,应该滴入酚酞;
D.溶度积越小的难溶物越容易生成沉淀.
解答 解:A.漂白粉中的Ca(ClO)2可与空气中的二氧化碳反应生成CaCO3和不稳定的次氯酸,氯化钙不与二氧化碳反应,故A错误;
B.用坩埚钳夹住点燃的镁条伸入二氧化碳气体中,镁条剧烈燃烧生成MgO,Mg做还原剂、二氧化碳为氧化剂,故B错误;
C.向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙,溶液呈黄色,只能说明溶液的pH>4.4,无法证明NaHCO3溶液呈碱性,应该滴入酚酞,故C错误;
D.向浓度均为0.1mol•L-1的Al2(SO4)3、Fe2(SO4)3的溶液中逐滴加入氨水,先有红褐色沉淀生成,后有白色色沉淀生成,说明氢氧化铁更难溶,则氢氧化铁的溶度积较小,即Al(OH)3的溶度积比Fe(OH)3的大,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,涉及漂白粉性质、难溶物溶度积大小比较、盐的水解原理、氧化还原反应等知识,明确常见元素及其化合物性质为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 周期表中的主族中都既有非金属元素又有金属元素 | |
| D. | 原子的最外层电子数相同的元素,一定属于同一族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 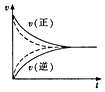 用实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化 | |
| B. | 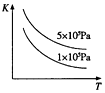 表示反应2SO2(g)+O2(g)?2SO3(g)△H<0的平衡常数K与温度和压强的关系 | |
| C. | 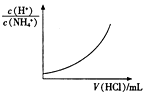 表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$随HCl溶液体积变化关系 | |
| D. | 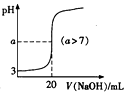 表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
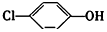 ),同时利用此装置的电能在铁上,下列说法正确的是( )
),同时利用此装置的电能在铁上,下列说法正确的是( )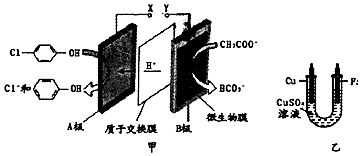
| A. | 当外电路中有0.2mol e-转移时,A极区增加的H+的个数为0.2 NA | |
| B. | A极的电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+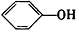 | |
| C. | 乙装置中铁电极应与甲装置中X相连接 | |
| D. | 电镀过程中乙装置中CuSO4溶液浓度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A太阳能热水器 | B.火力发电 | C.发电机中燃料燃烧 | D.中国古代制陶 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  所示装且制取Fe(OH)2 | |
| B. | 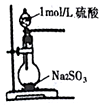 所示装置制取SO2 | |
| C. | 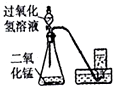 所示装置制取O2 | |
| D. | 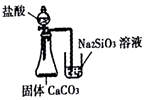 所示装置比较Cl、C、Si的非金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com