
在硫酸铝、硫酸和硫酸镁的混合溶液1000mL中,c(Al3+) = 0.2mol/L,当加入等体积1.6mol/L KOH溶液时,生成的沉淀最多,再加入过量的KOH溶液后,经过滤、洗涤、干燥,得白色沉淀11.6g。则反应前的混合溶液中c(H2SO4)是 ( )
A. 0.20mol/L B.0.30mol/L C.0.40mol/L D.0.60mol/L
科目:高中化学 来源: 题型:
某化学小组欲以CO2为主要原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。
【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
然后再将NaHCO3制成Na2CO3。
【实验设计】

|
【实验探究】
(1)装置乙的作用是 。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,NaHCO3转化为Na2CO3的化学方程式为
。
(3)若在(2)中灼烧时间较短,NaHCO3将分解不完全。取经短暂加热的NaHCO3 样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
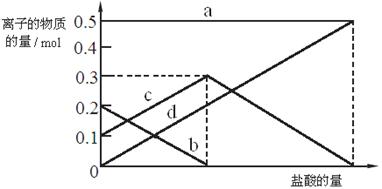
则曲线b对应的溶液中的离子是 (填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是 。
(4)若将装置甲产生的纯净的CO2 1.12 L(标准状况下)缓慢地全部通入到100 mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为4.86 g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.04mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是 ( )
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-
B.该混合液中—定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+
D.该混合液中:c(K+) ≥ 0.02mol/L c(CO32-) = 0.02mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径正确的是 ( )
A.经常饮用咖啡、碳酸饮料 B.经常饮用钙离子含量高的硬水
C.经常饮用牛奶、豆奶 D.大量补充维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,NO能跟H2发生如下反应:2NO+2H2==N2+2H2O。经研究,上述反应是按以下三步反应依次进行的总反应(括号中是该条件下反应的相对速率):(Ⅰ)2NO+H2==N2O+H2O(慢);(Ⅱ)2N2O==2N2+O2(快);(Ⅲ)2H2+O2==2H2O(更快)。以上总反应的速率主要取决于三步反应中的
A.(Ⅰ) B.(Ⅱ) C.(Ⅲ) D.(Ⅱ)和(Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,在一定条件下,进行下列反应:NO(g) + CO(g)  1/2N2(g) + CO2(g);△H <0(正反应放热),达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
1/2N2(g) + CO2(g);△H <0(正反应放热),达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2═2N0,经测定前3s用N2表示的反应速率为0.1mol/(L•s),则6S末N0的浓度为( )
|
| A. | 1.2 mol•L﹣1 | B. | 大于1.2 mol•L﹣1 | C. | 小于1.2 mol•L﹣1 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com