
【题目】下列实验结果不能作为相应定律或原理的证据是
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实 验 方 案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡, 试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2︰1 |
A. AB. BC. CD. D
【答案】B
【解析】
A.反应2NO2(g)![]() N2O4(g)的△H<0,为放热反应,结合温度对化学平衡的影响分析;
N2O4(g)的△H<0,为放热反应,结合温度对化学平衡的影响分析;
B.HCl不是含氧酸,盐酸酸性大于碳酸与元素周期律无关;
C.结合盖斯定律内容分析;
D.根据电子守恒计算生成氢气和氧气的物质的量,然后利用阿伏加德罗定律分析。
A.反应2NO2(g)![]() N2O4(g)的正反应为放热反应,左边热水中升高温度,化学平衡向吸热的逆反应方向移动,NO2浓度增大,所以左球气体颜色加深;右边冷水中降低温度,化学平衡向放热的正反应移动,NO2浓度减小,所以右球气体颜色变浅,因此能够用勒夏特列原理解释,A不符合题意;
N2O4(g)的正反应为放热反应,左边热水中升高温度,化学平衡向吸热的逆反应方向移动,NO2浓度增大,所以左球气体颜色加深;右边冷水中降低温度,化学平衡向放热的正反应移动,NO2浓度减小,所以右球气体颜色变浅,因此能够用勒夏特列原理解释,A不符合题意;
B.烧瓶中冒气泡,证明酸性:HCl>碳酸,但由于HCl不是含氧酸,因此无法用元素周期律解释,试管中出现浑浊也不能说明碳酸的酸性强于硅酸(因为二氧化碳气体中混有HCl,HCl与硅酸钠溶液反应也会出现浑浊),B符合题意;
C.根据盖斯定律可知:△H=△H1+△H2,因此能够用盖斯定律解释,C不符合题意;
D.根据电子守恒可知,电解水生成H2与O2的物质的量之比2:1,结合阿伏加德罗定律可知,H2与O2的体积比约为2:1,D不符合题意;
故答案是B。


科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学用语中,不正确的是
A. FeCl3溶液刻蚀铜电路板:2Fe3++Cu==2Fe2++Cu2+
B. Na2O2用作供氧剂:Na2O2+H2O==2NaOH +O2↑
C. 氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32![]() CaCO3(s)+SO42
CaCO3(s)+SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用平衡移动原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物(![]() )的说法错误的是
)的说法错误的是
A. 该分子中的5个碳原子可能共面
B. 与该有机物含相同官能团的同分异构体只有3种
C. 通过加成反应可分别制得烷烃、醇、卤代烃
D. 鉴别该有机物与戊烷可用酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)上述反应中生成二氧化硫的化学方程式为__。
(2)乙同学认为还可能产生氢气的理由是__。
(3)丙同学在安装好装置后,必须首先进行的一步操作是__。
(4)A中加入的试剂可能是__,作用是__;B中加入的试剂可能是__,作用是__;E中加入的试剂可能是__,作用是__。
(5)可以证明气体X中含有氢气的实验现象是:
C中:__,
D中:__。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?__(填“能”或“不能”),原因是_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是一种在微生物作用下将废水中的尿素CO(NH2)2转化为环境友好物质,实现化学能转化为电能的装置,并利用甲、乙两装置实现在铁上镀铜。下列说法中不正确的是
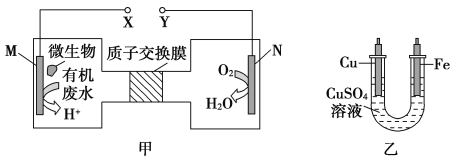
A. 乙装置中溶液颜色不变
B. 铜电极应与Y相连接
C. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com