
| A | B | C | D | |
| 装置 | 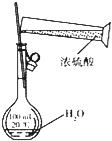 |
 |
 |
 |
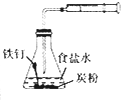
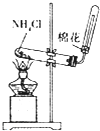
| 目的 | 配制稀硫酸 | 探究铁的吸氧腐蚀 | 实验室制备氨气 | 除去乙烯中的乙烷 |
| A、A | B、B | C、C | D、D |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
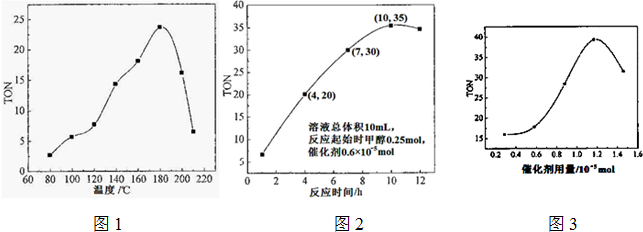
| H2CO3 |
| HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
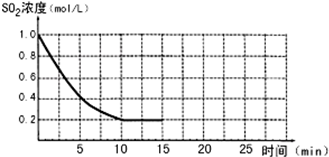 已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:
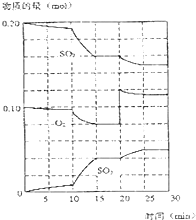 在一定条件下,二氧化碳和氧气发生如下反应:
在一定条件下,二氧化碳和氧气发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
| A、若25<t1<t2,则a<1×10-14 |
| B、t2℃时,将一定物质的量浓度的盐酸与氢氧化钠溶液中和后,所得混合溶液pH=7,溶液呈中性 |
| C、25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1 |
| D、t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合,所得混合溶液的pH=2,则V1:V2=11:9(设混合后溶液的体积为原两溶液体积之和) |
查看答案和解析>>
科目:高中化学 来源: 题型:
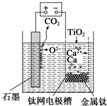 如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )
如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )| A、阳极反应式为C+2O2--4e-═CO2↑ |
| B、由TiO2制得1mol金属Ti,理论上外电路转移4mol电子 |
| C、制备金属钛前后,装置中CaO的量不变 |
| D、TiO2在阴极放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | ||||
B、用石墨电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ | ||||
| D、等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合:3HCO3-+2Ca2++3OH-═2CaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
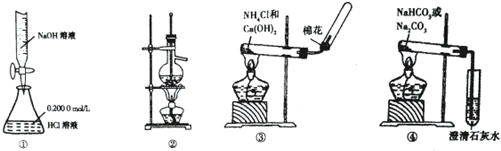
| A、用图①所示装置测定NaOH的浓度 |
| B、用图②所示装置分馏少量石油 |
| C、用图③所示装置在实验室制备收集氨气 |
| D、用图④所示装置鉴别碳酸钠和碳酸氢钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com