
已知:I2+2S2O ===S4O
===S4O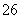 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是______________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是____________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是______________________。
②CuCl2溶液与KI反应的离子方程式为__________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
解析 (1)调节溶液pH时不应该带入其他杂质,故可选择Cu(OH)2、Cu2(OH)2CO3等物质消耗溶液中的H+,使溶液的pH升高;当溶液的pH=4时,c(H+)=1×10-4 mol·L-1,c(OH-)=1×10-10 mol·L-1,由Fe(OH)3的Ksp计算可得c(Fe3+)=Ksp/c3(OH-)=2.6×10-39/(1×10-30)=2.6×10-9(mol·L-1)。(2)由于加热能促进CuCl2的水解,且生成的HCl又易挥发而脱离体系,造成水解较完全,最终不能得到纯的无水CuCl2,反应方程式为2CuCl2·2H2O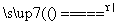 Cu(OH)2·CuCl2+2HCl+2H2O;要得到纯的无水CuCl2是让CuCl2·2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的过程中发生反应:2Cu2++4I-===2CuI↓+I2,滴定过程中I2完全消失是滴定的终点,故可选用淀粉溶液作滴定指示剂,滴定终点的现象为蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-===2CuI↓+I2,I2+2S2O
Cu(OH)2·CuCl2+2HCl+2H2O;要得到纯的无水CuCl2是让CuCl2·2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的过程中发生反应:2Cu2++4I-===2CuI↓+I2,滴定过程中I2完全消失是滴定的终点,故可选用淀粉溶液作滴定指示剂,滴定终点的现象为蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-===2CuI↓+I2,I2+2S2O ===S4O
===S4O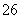 +2I-,可知Cu2+~S2O
+2I-,可知Cu2+~S2O ,n(Cu2+)=0.100 0 mol·L-1×20.00×10-3 L=2.0×10-3 mol,m(CuCl2·2H2O)=2.0×10-3 mol×171 g·mol-1=0.342 g,则试样中CuCl2·2H2O的质量百分数为0.342 g÷0.36 g×100%=95%。
,n(Cu2+)=0.100 0 mol·L-1×20.00×10-3 L=2.0×10-3 mol,m(CuCl2·2H2O)=2.0×10-3 mol×171 g·mol-1=0.342 g,则试样中CuCl2·2H2O的质量百分数为0.342 g÷0.36 g×100%=95%。
答案 (1)Cu(OH)2或Cu2(OH)2CO3
2.6×10-9 mol·L-1
(2)2CuCl2·2H2O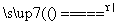 Cu(OH)2·CuCl2+2HCl+2H2O 在干燥的HCl气流中加热脱水
Cu(OH)2·CuCl2+2HCl+2H2O 在干燥的HCl气流中加热脱水
(3)①淀粉溶液 蓝色褪去,放置一定时间后不复色
②2Cu2++4I-===2CuI↓+I2 ③95%


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
铝可与硝酸钠发生反应(未配平):Al+NaNO +H
+H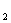 O
O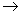 Al(OH)
Al(OH)  +N
+N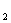
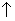 +NaAlO
+NaAlO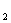 ,有关叙述正确的是
,有关叙述正确的是
A. 上述反应中水是氧化剂
B. 若反应过程中转移5 mol e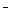 则生成标准状况下N
则生成标准状况下N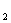 的体积为11.2L
的体积为11.2L
C. 该反应的氧化产物是N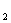
D. 当消耗1 mol Al时,生成标况下N 的体积为22.4L
的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
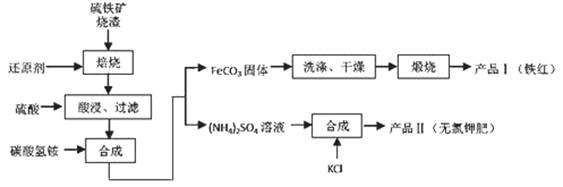
下列关于如图所示装置的说法,正确的是( )
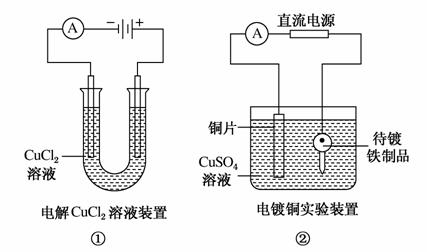
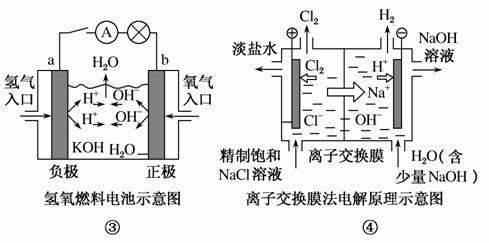
A.①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,取浓度相同的NaOH和HCl溶液,以32体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol·L-1 B.0.017 mol·L-1
C.0.05 mol·L-1 D.0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数为________________。
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合。
(1)若所得混合液为中性,且a=2,b=12,则VaVb=________。
(2)若所得混合液的pH=10,且a=2,b=12,则VaVb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质结构的描述不正确的是( )
A.氯乙烯分子中的所有原子均在同一平面上
B.乙烷分子中的所有原子可能都在同一平面上
C.苯分子是平面正六边形
D.苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe(OH)3+3H+=Fe2++3H2O
硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
已知几种盐的溶解度随温度变化的曲线如右图所示:回答下列问题:
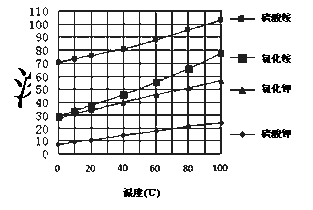

(1)酸浸、过滤后滤液中的金属阳离子是______________。
(2)煅烧 FeCO3生成产品 I的化学反应方程式为 _______。实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向 (NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用乙炔为原料制取CHClBr—CH2Br,下列方法中最可行的是( )
A.先与HBr加成后再与HCl加成
B.先与H2完全加成后再与Cl2、Br2取代
C.先与HCl加成后再与Br2加成
D.先与Cl2加成后再与HBr加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com