
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:分析 A、B、C、D为原子序数依次增大的四种元素,C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)同周期自左而右电负性增大,Cl元素氧化物中氧元素表现负价,四种元素电负性最大的为O元素;C为P元素,原子核外电子数为15,根据能量最低原理原理书写核外电子排布式;
(2)A为O元素,有O2、O3两种同素异形体,均属于分子晶体,相对原子质量越大,沸点越高;
A、B的氢化物分别为H2O、NaH,前者为分子晶体、后者为离子晶体;
(3)C和D生成组成比为1:3的化合物E为PCl3,计算P原子价层电子对数、孤电子对数,确定杂化方式与空间构型;
(4)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,则形成的化合物为Na2O,由晶胞结构可知B原子配位数为4,计算晶胞质量和体积,可计算密度.
解答 解:A、B、C、D为原子序数依次增大的四种元素,C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素.
(1)同周期自左而右电负性增大,Cl元素氧化物中氧元素表现负价,四种元素电负性最大的为O元素;C为P元素,原子核外电子数为15,根据能量最低原理原理,核外电子排布式为:1s22s22p63s23p3,
故答案为:O;1s22s22p63s23p3;
(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对原子质量较大,则范德华力较大,沸点较高,A的氢化物为H2O,属于分子晶体,B的氢化物为NaH,属于离子晶体,
故答案为:O3;O3相对原子质量较大,范德华力较大;分子晶体;离子晶体
(3)C和D生成组成比为1:3的化合物E为PCl3,孤电子对数为$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,杂化轨道数目为,则为sp3杂化,立体构型为为三角锥形,
故答案为:三角锥形;sp3;
(4)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Na):N(O)=2:1,则形成的化合物为Na2O;
晶胞的质量为$\frac{4×62g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$,晶胞的体积为(0.566×10-7)cm3,则晶体F的密度为$\frac{4×62g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$÷(0.566×10-7)cm3=2.27g•cm-3,
故答案为:Na2O;2.27g•cm-3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、沸点比较、杂化方式与空间构型判断、晶胞计算等,掌握均摊法进行晶胞有关计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 保持温度和容器内压强不变,充入1molNH3(g) | |
| B. | 保持温度和容器内压强不变,充入1molAr(g) | |
| C. | 保持温度和容器体积不变,充入1molN2(g) | |
| D. | 保持温度和容器体积不变,充入1molNH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电源有一次电池、二次电池和燃料电池等,一次电池只能放电,不能充电 | |
| B. | 铅蓄电池应用广泛,是一种常见的可充电电池,放电过程中电解质溶液密度逐渐增大 | |
| C. | 燃料电池具有能量利用率高、可连续使用和污染轻等优点 | |
| D. | 锂电池是一种高能电池,体积小、重量轻,单位质量电极放出的电能多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
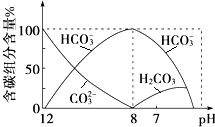 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
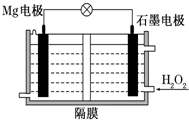 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 电子从石墨电极移向Mg电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
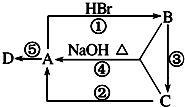 如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:
如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 水电离出来的c(H+)=1.0×10-12mol/L的溶液中,Al3+不可能大量存在 | |
| C. | 0.1mol/L的氨水中滴加稀盐酸至过量,可能有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在25℃时,将pH=5的醋酸溶液与pH=9的KOH溶液等体积混合,则充分反应后的混合液:c(CH3COO-)>c(H+)>c(K+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0℃、1.01×105 Pa的条件下,某气体的体积约为2.24×10-2 m3,该气体的物质的量为1 mol | |
| B. | 1 mol某气体的体积为22.4 L,该气体所处的状况必定为标准状况 | |
| C. | 在20℃的温度下,1 mol某气体的体积约为22.4 L,该气体的压强为101 kPa | |
| D. | 固态的二氧化碳又叫干冰,含CO2 1 mol的干冰在标准状况下的体积必定小于22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com