考点:物质分离和提纯的方法和基本操作综合应用,反应速率的定量表示方法,化学平衡的影响因素,化学平衡的计算,铁的氧化物和氢氧化物
专题:实验设计题,化学平衡专题
分析:Ⅰ.(1)铁物质的量=
=0.02mol,根据化学方程式定量关系计算甲烷消耗的物质的量,依据化学反应速率概念计算得到;
(2)依据化学反应特征和影响平衡因素,结合化学平衡移动原理分析;
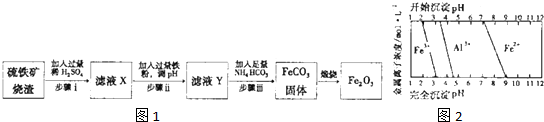
Ⅱ.(3)依据图象分析可知加入铁是还原铁离子,同时调节溶液PH除去铝离子,亚铁离子不生成沉淀,溶液PH不高于7;
(4)流程分析,步骤i是硫酸溶解后过滤除去不溶杂质,步骤ii是加入过量铁调节溶液PH,过滤得到滤液除去过量铁,步骤iii是过滤得到碳酸亚铁沉淀;
(5)依据电离平衡常数结合反应平衡常数表达式计算推断得到;
(6)在空气中煅烧FeCO
3生成氧化铁和二氧化碳,依据原子守恒配平书写化学方程式;
(7)依据氧化铁不溶于氢氧化钠溶液,氧化铝和二氧化硅能溶解于氢氧化钠溶液设计实验.
解答:
解:(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为1.12g,铁物质的量=
=0.02mol,结合化学方程式,Fe
2O
3(s)+3CH
4(g)═2Fe(s)+3CO(g)+6H
2(g),计算反应的甲烷物质的量为0.03mol,则该段时间内CH
4的平均反应速率=
=0.003mol/(L?min);
故答案为:0.003mol?L
-1?min
-1;
(2)Fe
2O
3(s)+3CH
4(g)═2Fe(s)+3CO(g)+6H
2(g)△H>0,反应是气体体积不变的吸热反应
a.若加入催化剂,V
逆,v
正增大,速率同等程度增大,平衡不发生移动,故a错误;
b.反应是吸热反应,若温度升高,平衡正向进行,平衡常数K增大,故b错误;
c.若增大Fe
2O
3的量,氧化铁是固体不允许平衡,平衡不移动,故d错误;
d.若从反应体系中移走部分CO,减少生成物,平衡正向进行,可提高CH
4的转化率,故d正确;
故答案为:d;
(3)根据图象可知,亚铁离子开始沉淀时的pH值是7,所以要得到碳酸亚铁,同时调节溶液PH除去铝离子,亚铁离子不生成沉淀,则溶液的pH不能高于7,且大于4.7,故答案为:4.7~7;
(4)判断步骤ⅱ反应主要为Fe
3++2Fe═3Fe
2+,调节溶液pH,得到纯净的Fe
2+,此时铝离子以Al(OH)
3沉淀形成去除,故答案为:Fe
3++2Fe═3Fe
2+;Al(OH)
3;
(5)反应Fe
2+(aq)+2HCO
3-(aq)═FeCO
3(s)+H
2CO
3(aq)的平衡常数
K=
=
| c(H2CO3)c(CO32-) |
| c(Fe2+)c(CO32-)c2(HCO3-) |
=
=
=4.06×10
6;
故答案为:4.06×10
6;
(6)在空气中煅烧FeCO
3生成氧化铁和二氧化碳,依据原子守恒分析,生成氧化铁同时生成二氧化碳,反应的化学方程式为:4FeCO
3+O
22Fe
2O
3+4CO
2,
故答案为:4FeCO
3+O
22Fe
2O
3+4CO
2;
(7)由于氧化铝与二氧化硅均能和氢氧化钠溶液反应,而氧化铁和氢氧化钠溶液不反应,因此要提取氧化铁的实验方案可以设计为取少量磁铁矿烧渣,加入足量热的浓氢氧化钠溶液中,搅拌,过滤,洗涤烘干得到;
故答案为:取少量磁铁矿烧渣,加入足量热的浓氢氧化钠溶液中,搅拌,过滤,洗涤烘干得到.
点评:本题较为综合,涉及反应速率计算,化学平衡和反应速率的影响因素,方程式书写方法,物质分离与提纯,实验方案设计,平衡常数的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握实验的流程分析.题目难度中等.



 如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: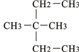 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥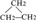 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?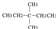 ?CH≡CH?
?CH≡CH?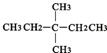 ?H2
?H2