
NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料制得的产品(或物质)是( )
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A.①②③④⑤ B.①②③④
C.①②③⑤ D.①②④⑤
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2OH-—→ZnO+H2O+2e-
C.正极发生氧化反应
D.电解液可以是强酸也可以是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NOONH4(s) 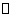 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度( | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
氨基甲酸铵分解反应的焓变 H__________0(填“>”、“<”或“=”)
H__________0(填“>”、“<”或“=”)
可以判断该分解反应已经达到化学平衡的是____________.(填字母)
A. 2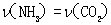
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
根据表中数据,计算25.0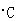 时的分解平衡常数为____________.
时的分解平衡常数为____________.
(2) 25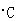 时,NH3·H2O电离常数Kb=1.8
时,NH3·H2O电离常数Kb=1.8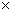 10-5,Mg(OH)2的溶度积常数Ksp=1.8
10-5,Mg(OH)2的溶度积常数Ksp=1.8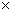 10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3
10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3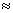 0.5)
0.5)
在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)=_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列各组物质归类中与分类标准不一致的是 ( )
| 选项 | 分类标准 | 物质归类 |
| A | NO2、MnO2、Na2O2、Na2O2、Al2O3 | CO |
| B | CH3COOH、HOOC-COOH、HClO、H2S | HF |
| C | 复分解反应、电解反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)2SO4、NH4Cl、NH4NO3、(NH4)2CO3 | NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是 ( )
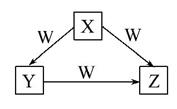
| X | Y | Z | W | |
| A | C | CO | CO2 | O2 |
| B | Na | Na2O | Na2O2 | O2 |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | Fe | FeCl2 | FeCl3 | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
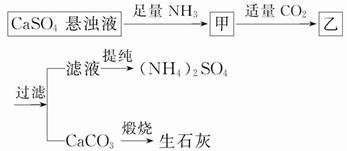
下列推断不合理的是( )
A.向甲中通适量CO2有利于(NH4)2SO4生成
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.CO2可被循环利用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图示装置进行有关实验,其中能达到实验目的或得出正确结论的是
| 选项 | ① | ② | ③ | ④ | 实验目的或结论 | 装置 |
| A | 浓盐酸 | MnO2 | 干燥红色布条 | NaOH溶液 | 干燥布条不褪色 |
|
| B | 稀硝酸 | 铜粉 | 空气 | NaOH溶液 | 制备收集NO | |
| C | 浓硫酸 | 木炭 | 品红溶液 | NaOH溶液 | 浓硫酸具有氧化性 | |
| D | 浓氨水 | NaOH固体 | 空气 | 水 | 制备收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学欲分别完成“钠与氯气反应”的实验.
I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I).该方案的不足之处有 钠预先在空气中加热,会生成氧化物,影响钠在氯气中燃烧;实验过程中会产生少量污染 (至少答出两点).
II.乙同学所采用的装置如图Ⅱ,回答下列问题:
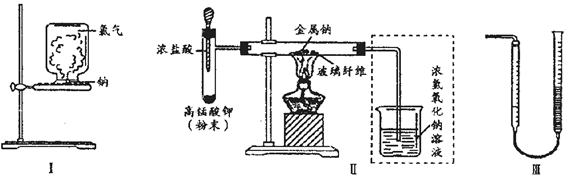
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;待装置中出现 现象后,点燃酒精灯.
(2)点燃酒精灯后,玻璃管中出现的现象是 钠熔化并燃烧,产生黄色火焰,有白烟(至少答出两点)
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积.
①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是
碱式(填“酸式”或“碱式”)滴定管.
②为提高测量的准确性,图Ⅲ装置中的液体可用 饱和NaCl溶液;收集完气体并冷却至室温后读数,读数前应进行的操作是 .
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积 (填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O===O | P===O |
| 键能/kJ·mol-1 | 172 | 335 | 498 | X |
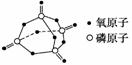
已知白磷的燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=____________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为____________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com