
分析 铁为变价金属,氯气具有强氧化性,铁和氯气反应生成氯化铁呈棕黄色固体,氯化铁溶解后得到氯化铁溶液为棕黄色溶液,加入硫氰化钾溶液溶液和铁离子结合生成血红色溶液,溶液中加入铁还原铁离子,化学平衡逆向进行红色消失,通入足量氯气,氯气氧化亚铁离子生成铁离子溶液又生成硫氰酸铁红色溶液;
解答 解:铁为变价金属,氯气具有强氧化性,铁和氯气反应生成氯化铁呈棕黄色固体,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,氯化铁溶解后得到氯化铁溶液为棕黄色溶液,加入硫氰化钾溶液溶液和铁离子结合生成血红色溶液,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,溶液中加入铁还原铁离子,反应的离子方程式为:2Fe3++Fe=3Fe2+,化学平衡逆向进行红色消失,通入足量氯气,氯气氧化亚铁离子生成铁离子溶液又生成硫氰酸铁红色溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:棕黄色的烟;棕黄色;硫氰化钾溶液;2Fe+3Cl2=2FeCl3;Fe3++3SCN-=Fe(SCN)3;2Fe3++Fe=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查了铁及其化合物性质、离子检验、氧化还原反应产物判断和离子方程式书写,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | E(5s)>E(4f)>E(4s)>E(3d) | B. | E(4f)>E(3d)>E(4s)>E(3p) | C. | E(5d)>E(4d)>E(3d)>E(2d) | D. | E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
(1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
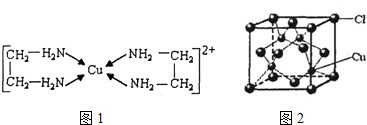
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
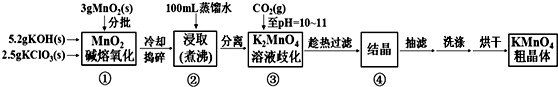
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
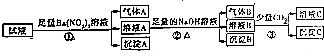
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com