
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 |
|
阳离子 | Al3+、Cu2+、Mg2+、 |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
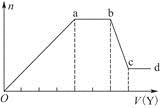
①若Y是盐酸,则溶液中含有的金属阳离子是____________________________,
ab段发生反应的总离子方程式为______________________________________,
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为
_________________________________________________________________。
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为____________________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:
___________________________________,________________________________。
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
(1)①Na+ 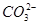 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
n(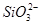 )∶n(
)∶n( )=11∶2
)=11∶2
②Al(OH)3+OH-= +2H2O
+2H2O
N(Al3+)∶N(Mg2+)∶N(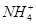 )∶N(Cl-)=2∶1∶4∶12
)∶N(Cl-)=2∶1∶4∶12
(2)①Sn+2H+=Sn2++H2↑
Sn2++Cl2=Sn4++2Cl-
②SnO2 ③NH3·H2O
【解析】
(1)①若Y为盐酸,则Oa段反应为2H++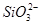 =H2SiO3↓、H++
=H2SiO3↓、H++ +H2O=Al(OH)3↓,ab段反应为2H++
+H2O=Al(OH)3↓,ab段反应为2H++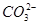 =H2O+CO2↑,bc段反应为Al(OH)3+3H+=Al3++3H2O;X溶液中含有
=H2O+CO2↑,bc段反应为Al(OH)3+3H+=Al3++3H2O;X溶液中含有 和
和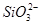 ,故阳离子中只有Na+可以存在;设bc段反应消耗的H+的物质的量为x,则根据bc段反应可得:n(
,故阳离子中只有Na+可以存在;设bc段反应消耗的H+的物质的量为x,则根据bc段反应可得:n( )=
)=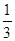 x,根据Oa段反应可得:n(
x,根据Oa段反应可得:n( )+2n(
)+2n(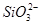 )=4x,解得n(
)=4x,解得n( )∶n(
)∶n(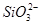 )=2∶11。②若Y为NaOH溶液,则Oa段反应为Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,ab段反应为
)=2∶11。②若Y为NaOH溶液,则Oa段反应为Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,ab段反应为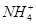 +OH-
+OH- NH3·H2O,bc段反应为Al(OH)3+OH-=
NH3·H2O,bc段反应为Al(OH)3+OH-= +2H2O;设bc段反应消耗的OH-的物质的量为y,则根据ab段反应可得n(
+2H2O;设bc段反应消耗的OH-的物质的量为y,则根据ab段反应可得n(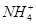 )=2y,根据bc段反应可得n(
)=2y,根据bc段反应可得n( )=y,则根据元素守恒可知n(Al3+)=y,根据Oa段反应可得3n(Al3+)+2n(Mg2+)=4y,解得n(Mg2+)=y,根据电荷守恒可得n(Cl-)=6y,可得:n(Al3+)∶n(Mg2+)∶n(
)=y,则根据元素守恒可知n(Al3+)=y,根据Oa段反应可得3n(Al3+)+2n(Mg2+)=4y,解得n(Mg2+)=y,根据电荷守恒可得n(Cl-)=6y,可得:n(Al3+)∶n(Mg2+)∶n(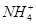 )∶n(Cl-)=2∶1∶4∶12。(2)①Sn的简单阳离子为Sn2+和Sn4+,可迁移铁与盐酸反应,其产物再与氯气反应的离子方程式;②FeCl3溶液蒸干后继续加热所得固体为Fe2O3,故SnCl4溶液蒸干后继续加热所得固体应为SnO2;③由2H++SnO
)∶n(Cl-)=2∶1∶4∶12。(2)①Sn的简单阳离子为Sn2+和Sn4+,可迁移铁与盐酸反应,其产物再与氯气反应的离子方程式;②FeCl3溶液蒸干后继续加热所得固体为Fe2O3,故SnCl4溶液蒸干后继续加热所得固体应为SnO2;③由2H++SnO Sn(OH)2
Sn(OH)2 Sn2++2OH-可知Sn(OH)2具有两性,故应用弱碱NH3·H2O和SnCl2反应制取Sn(OH)2以避免其与强碱反应。
Sn2++2OH-可知Sn(OH)2具有两性,故应用弱碱NH3·H2O和SnCl2反应制取Sn(OH)2以避免其与强碱反应。


科目:高中化学 来源:2014高考名师推荐化学离子方程式正误判断(解析版) 题型:选择题
下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na+ +2OH- + H2↑
B.硅酸钠溶液与醋酸溶液混合:SiO3 2-+2H+=H2SiO3↓
C.0.01mol/L NH4Al(SO4)2 溶液与0.02mol/L Ba(OH)2 溶液等体积混合:NH4+ +Al3++2SO42- +2Ba2+ +4OH- =2 Ba SO4 ↓+Al(OH)3 ↓+ NH3·H2O
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ Fe3+ +3NO2+3H2O
Fe3+ +3NO2+3H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是
A.水溶液中:K+、Ca2+、Cl-、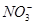
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、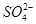 、葡萄糖分子
、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学碳及其化合物主要性质(解析版) 题型:选择题
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如下图所示,图中AB段表示的离子方程式先后顺序正确的是

①CO2+OH-=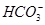 ②CO2+2OH-=
②CO2+2OH-=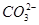 +H2O
+H2O
③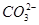 +Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2
+Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2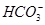
⑤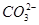 +CO2+H2O=2
+CO2+H2O=2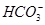
A.③① B.②⑤ C.⑤④ D.④②
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+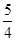 O2(g)===
O2(g)===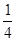 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
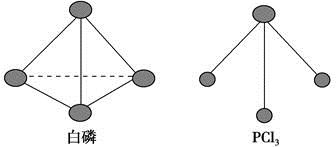
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)—→C(s)+2H2(g)的ΔH是
A.-74.8 kJ·mol-1 B.+74.8 kJ·mol-1
C.-211.0 kJ·mol-1 D.+211.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:选择题
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入
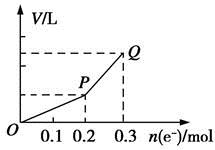
A.0.1 mol CuO B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学环境污染与保护(解析版) 题型:选择题
有关海洋中部分资源的利用的说法不正确的是
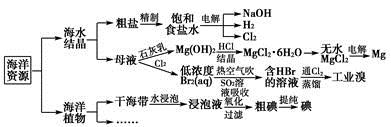
A.工业上利用Cl2与澄清石灰水反应制取漂白粉
B.用MgCl2·6H2O晶体制无水MgCl2,需在HCl气流中加热脱水
C.SO2水溶液吸收Br2的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr
D.粗碘中混有少量ICl和IBr可加入KI进行升华提纯
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
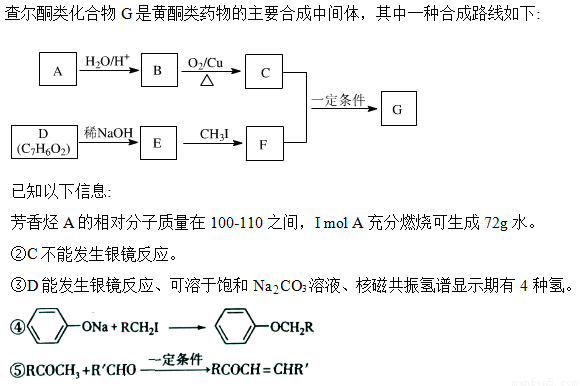
回答下列问题:
(1)A的化学名称为____________。
(2)由B生成C的化学方程式为____________________。
(3)E的分子式为________________,由E生成F的反应类型为________。
(4)G的结构简式为____________________。
(5)D的芳香同分异构体H既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有_______种,其中核磁共振氢谱为5组峰,且峰面积为2:2:2:1:1的为________________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com