
 Cr2O3)冶炼铬的工艺流程如下:
Cr2O3)冶炼铬的工艺流程如下: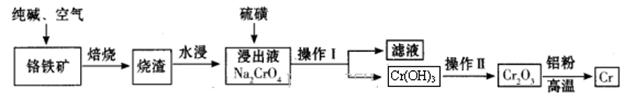
 Cr2O72-+H2O)。
Cr2O72-+H2O)。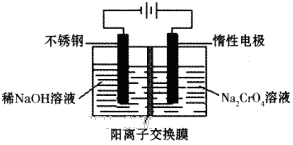
 2Cr + Al2O3 (2分,不写反应条件不扣分,化学式写错、不配平不得分)
2Cr + Al2O3 (2分,不写反应条件不扣分,化学式写错、不配平不得分)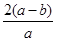 ×100% (2分,合理答案即可)
×100% (2分,合理答案即可) 2Cr + Al2O3。
2Cr + Al2O3。 Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是
Cr2O72-+H2O可知,消耗铬酸钠的物质的量是(a-b)mol。反应前铬酸钠的物质的量是0.5amol,所以铬酸钠的转化率是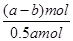 ×100%=
×100%=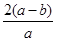 ×100%。
×100%。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源:不详 题型:填空题
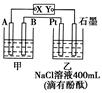
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
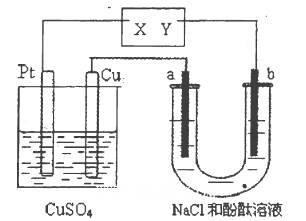
| A.X是正极,Y是负极 | B.X是负极,Y是正极 |
| C.CuSO4溶液的浓度逐渐减小 | D.CuSO4溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
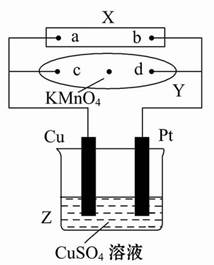
| A.滤纸上c点附近会变红色 |
| B.Cu电极质量减小,Pt电极质量增大 |
| C.Z中溶液的pH先减小,后增大 |
| D.溶液中的SO42-向Cu电极定向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
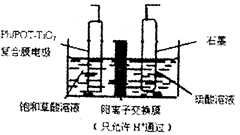
| A.电解时石墨电极应与直流电源的正极相连 |
| B.阴极反应式为:HOOCCOOH+2H++2e-=OHCCOOH+H2O |
| C.电解时石墨电极上有O2放出 |
| D.电解一段时间后,硫酸溶液的pH不变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

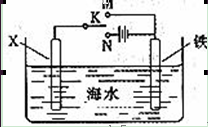
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
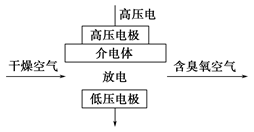
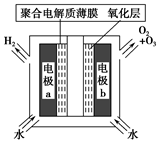
A.高压放电法,反应的原理为3O2 2O3 2O3 |
| B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物 |
| C.电解时,电极b周围发生的电极反应有3H2O-6e-=O3↑+6H+和2H2O-4e-=O2↑+4H+ |
| D.电解时,H+由电极a经聚合固体电解质膜流向电极b |
查看答案和解析>>
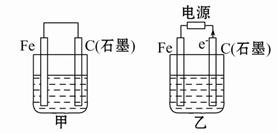
科目:高中化学 来源:不详 题型:单选题
| A.电解时可以精铜为阳极,以CuSO4溶液为电解液 |
| B.电解时阴极发生还原反应 |
| C.粗铜连接电源负极,其电极反应是Cu-2e—=Cu2+ |
| D.电解结束后,电解质溶液的浓度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com