
 .
.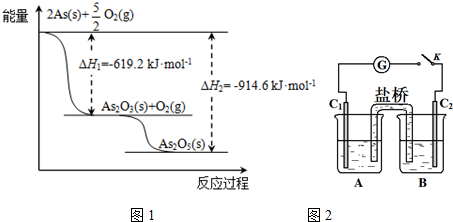
分析 (1)最外层有5个电子,由同主族位置和元素周期律可知,非金属性N>As;
(2)As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,以此书写热化学方程式;
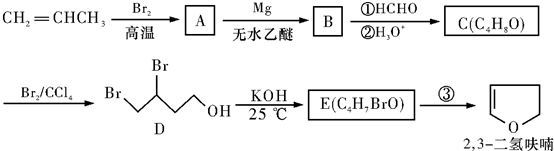
(3)①发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应;
②向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极.
(4)①根据As2O5与NaOH溶液反应生成盐和水书写离子方程式;
②上述混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+反应,则消耗AsO33-的物质的量为0.02500mol•L-1×20.00×10-3L=5×10-4mol,新生成的AsO43-的物质的量也为5×10-4mol;设原As2O5 的物质的量:x,
由As2O5→2AsO43-,则由As2O5 与氢氧化钠反应生成的AsO43-的物质的量为2x,后又加入过量的KI,又发生AsO42-+2I-+2H+═AsO32-+I2+H2O,
析出的I2又用0.1000mol•L-1的Na2S2O3溶液滴定,发生反应为I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液30.00mL,
所以有AsO43-~I2~2Na2S2O3,据消耗的Na2S2O3计算.
解答 解:(1)最外层有5个电子,则As位于第ⅤA族,由同主族位置和元素周期律可知,非金属性N>As,则As的气态氢化物的稳定性比NH3弱,
故答案为:ⅤA;弱;
(2)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(3)①B中滴加浓盐酸时发生AsO43-+2I-+2H+?AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO32-+H2O,
故答案为:AsO42-+2H++2e-=AsO32-+H2O;
②向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,可观察到电流计指针向左偏,
故答案为:向左偏.
(4)①因为As2O5为碱性氧化物,与NaOH溶液反应生成盐和水,所以离子方程式为:As2O5+6OH-═2AsO43-+3H2O,
故答案为:As2O5+6OH-═2AsO43-+3H2O;
②上述混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+反应,
则消耗AsO33-的物质的量为0.02500mol•L-1×20.00×10-3L=5×10-4mol,新生成的AsO43-的物质的量也为5×10-4mol;
设原As2O5 的物质的量:x,
由As2O5→2AsO43-,则由As2O5 与氢氧化钠反应生成的AsO43-的物质的量为2x,
后又加入过量的KI,又发生AsO42-+2I-+2H+═AsO32-+I2+H2O,析出的I2又用0.1000mol•L-1的Na2S2O3溶液滴定,发生反应为I2+2Na2S2O3=2NaI+Na2S4O6,
消耗Na2S2O3溶液30.00mL,
所以有AsO43-~I2~2Na2S2O3
1 2
2x+5×10-4 0.1×30×10-3
解得:x=0.0005 mol
m(As2O5)=0.0005×230=0.115 g
故答案为:0.115.
点评 本题考查较综合,涉及元素的位置及元素周期律、热化学方程式、原电池的工作原理等,注重高考高频考点的考查,侧重学生分析能力及知识迁移应用能力的考查,(4)为解答的难点,注意利用反应方程式中各物质之间的关系计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 正极反应为2CO2+O2+4e-═2CO32- | |
| B. | CO32-向正极移动 | |
| C. | 电子由正极经外电路流向负极 | |
| D. | 电池中CO32-的物质的量将逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、Al、H2 | B. | F2、K、HCl | C. | NO2、Na、Br2 | D. | HNO3、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 离子半径:W3+>Y2->Z+ | D. | 单质沸点:W>X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=13的NaOH溶液中含有的OH-的数为0.1 NA | |
| B. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为1 NA | |
| C. | 18g D2O中含有的质子数为9NA | |
| D. | 标准状况下,含4 mol HCl的浓盐酸与足量MnO2加热反应可生成22.4 L氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与乙酸乙酯的混合物,可通过蒸馏或用足量饱和碳酸钠溶液洗涤后分液的方法进行分离 | |
| B. | 做金属钠和水反应实验时,切割下来的表层物质,也不能直接丢弃到废纸篓里,而应放回原试剂瓶 | |
| C. | 酸式滴定管在润洗时,可在滴定管中加入少量待装液,润洗后将溶液从滴定管的上口倒入废液缸中,重复2~3次,润洗完毕 | |
| D. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉加入到稀硫酸溶液中:Fe+2H+=Fe3++H2↑ | |
| B. | 氢氧化钠溶液吸收氯气:Cl2+2OH-=H2O+ClO-+Cl- | |
| C. | 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++SO42-═BaSO4↓ | |
| D. | 氯化铁溶液中加入铁粉:Fe+Fe3+═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨常用作制冷剂,是因为其沸点较高,很容易液化 | |
| B. | 常温下氨水与铁不反应,因此氨水可盛放在铁桶里 | |
| C. | 用热的纯碱溶液洗去油污,是因为纯碱可以增强油污的挥发性 | |
| D. | 氯气具有强氧化性,因此可漂白有色布料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com